Hoofdstuk 1 Atoombouw - Geocities.ws · 2011-04-02 · Hoofdstuk 1 Atoombouw 1.1. Stapstenen in de...
Transcript of Hoofdstuk 1 Atoombouw - Geocities.ws · 2011-04-02 · Hoofdstuk 1 Atoombouw 1.1. Stapstenen in de...

Hoofdstuk 1 Atoombouw
1.1. Stapstenen in de evolutie van het atoommodel
Atoomtheorie van Dalton (1808)
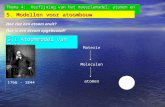
Aristoteles 384-322 v.C.
Reeds voor onze jaartelling werd druk gefilosofeerd over de bouw van de materie. In elke Griekse kroeg vond je wel een tafeltje met filosofen die over dit onderwerp debatteerden. Zij waren het oneens over de structuur van het suikerklontje1 dat bij de koffie2 geserveerd werd. De vraag die zij zich stelden was de volgende: “Wat gebeurt er als we dit klontje in twee breken, en nog eens in twee breken, en nog eens, en nog eens…?”. Volgens sommigen (Aristoteles) kon je dat tot in het oneindige blijven doen. Volgens anderen (Democritus) waren er grenzen en hield je op een bepaald ogenblik een stukje suiker over dat niet meer verder kon gesplitst worden. Volgens Democritus bestaat materie uit een oneindig aantal ondeelbare deeltjes, atomen, die bewegen in een oneindige, volstrekt lege ruimte. Deze deeltjes bestaan alle uit dezelfde oermaterie maar ze verschillen onderling in grootte, vorm en de positie die ze ten opzichte van elkaar kunnen innemen. Alle materie is opgebouwd uit zeer kleine niet meer verder te splitsen deeltjes, vandaar de naam atomen. Grieks: ’ατοµοσ (onsplitsbaar); ’ατοµειυ (niet meer te snijden); ’ατεµυω (ondeelbaar).
Democritus 460-380 v.C.
Antoine Lavoisier
1743-1794
De experimenten van Lavoisier waren de eerste chemische experimenten die kwantitatief werden uitgevoerd. Hij bewees dat wanneer een stof een chemische reactie ondergaat, de totale massa van begin tot eind hetzelfde blijft. Hij verbrandde fosfor en zwavel in lucht, en toonde aan dat de massa van de producten van die chemische reactie groter was dan de massa van de uitgangsstoffen. Maar, deze massastijging was gelijk aan de massadaling van de lucht. Deze experimenten lagen aan de basis van de wet van massabehoud. Als vooraanstaand belastinginner van het Ancien Régime werd Lavoisier gezien als een vijand van de revolutie, en in 1794 werd hij op 50-jarige leeftijd geguillotineerd. Guillotine
Dimitri Mendeleev
1834-1907
In 1869 publiceerde Mendeleev een tabel waarbij de elementen met analoge eigenschappen gegroepeerd werden. Dat deed het vermoeden rijzen dat in de gegroepeerde atomen één of meer gelijke delen zitten, waaruit volgt dat een atoom deelbaar zou zijn.
Eerste tabel van Mendeleev
1 Voor het zoeten van eten en drank gebruikten de mensen in de Oudheid meestal honing. De Indiërs wisten als eersten gekristalliseerde suiker uit suikerriet te halen. Hiervoor persten ze sap uit suikerriet. Ze kookten dat vervolgens in tot een bruine, zachte stroop, die later uitkristalliseerde tot suiker. 2 Koffie werd in de 17e eeuw vanuit Arabië via Turkije in Europa geïntroduceerd. In Arabië was koffie drinken aan het eind van de 15e eeuw een dagelijks ritueel. Arabieren worden dan ook beschouwd als de eerste koffiedrinkers.

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 2
John Dalton 1766-1844
In 1803 presenteerde Dalton zijn atoomtheorie tijdens een lezing. Zijn belangrijkste werk, waarin deze theorie verscheen, is “A new system of chemical philosophy” (1808). Ook op andere gebieden heeft Dalton baanbrekend werk verricht. Hij was kleurenblind en in 1794 publiceerde hij het eerste wetenschappelijke artikel over kleurenblindheid: “Extraordinary facts relating to the vision of colours”. Deze afwijking werd later naar hem genoemd: daltonisme3.
Symbolen volgens Dalton
Atoomtheorie van Dalton Alle materie is opgebouwd uit massieve niet meer te delen bollen, de atomen. De atomen van de verschillende elementensoorten (toen 36) onderscheiden zich van elkaar door verschillende straal en massa. Atomen van verschillende elementen kunnen zich in eenvoudige verhoudingen met elkaar binden tot bouwstenen van nieuwe stoffen. Wanneer zulke verbindingen worden ontbonden, vinden we de dezelfde atomaire bouwstenen terug.
Ontdekking van de elementaire deeltjes
Tengevolge van proeven met de kathodestraalbuis4 werden achtereenvolgens de elektronen en de protonen ontdekt. In 1879 toonde Crookes duidelijk aan dat kathodestralen niets anders zijn dan een stroom negatief geladen deeltjes die zich van de kathode naar de anode bewegen. Stoney noemde ze in 1891 elektronen naar het Griekse elektron (barnsteen), een steen die papiersnippers aantrekt wanneer hij eerst met een lap stof is gewreven. Na de ontdekking van de elektronen verwachtte men ook positieve atoomdelen te ontdekken. Dat gebeurde dan ook in 1886 toen Goldstein de straling onderzocht die door kanaaltjes, geboord in de kathode, kwam. Deze straling bleek zich van de anode naar de kathode te bewegen in tegengestelde richting van de kathodestralen. Onderzoek van deze uit positieve ionen bestaande straling leidde tot de ontdekking van de protonen.
Sir William Crookes
1832-1919
Kathodestraalbuis
3 Bij gehele of gedeeltelijke kleurenblindheid of daltonisme worden kleuren niet volledig normaal waargenomen. Meestal treedt kleurenblindheid op als één of meer van de drie typen kegeltjes in het oog niet goed of helemaal niet werken. Kleurenblindheid is meestal een geslachtsgebonden erfelijke aandoening. Volgens Dalton was kleurenblindheid te wijten was aan het verkleuren van de ooglens. Volgens zijn testament moesten na zijn dood zijn ogen verwijderd worden en zijn ooglenzen tegen het licht bekeken worden. Zijn hypothese bleek echter niet correct.
4 Een kathodestraalbuis is een luchtledige glazen buis waarin, aan beide uiteinden, twee elektrodes zitten: een kathode (negatief) en een anode (positief). Als de kathode verhit wordt, ontstaat er een straling die naar de anode stroomt. De kathodestralen wijken af in een magnetisch en in een elektrisch veld.

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 3
Beeldschermen
De televisieschermen die we nu kennen zagen er vroeger enigszins anders uit:
Hetzelfde geldt trouwens voor onze computerschermen:
CRT-beeldscherm (Cathode Ray Tube) De eerste televisie- en computerschermen waren van het CRT-type (Cathode Ray Tube = kathodestraalbuis). De kathodestraalbuis (vacuum = implosie-gevaar) bestaat uit een cilindrisch deel (hals) en een conisch verlopende overgang naar een beeldscherm (vroeger tamelijk bol, tegenwoordig bijna vlak). In de hals bevindt zich de kathode en de anode (elektronenkanon). Hier wordt een elektronenbundel opgewekt (kathode) en versneld (anode). Vervolgens doorloopt de bundel twee magnetische velden waarin hij afgebogen wordt. Deze velden worden opgewekt door twee spoelen die uitwendig over de hals geschoven zijn. Bij zwart-wit/monochroom beeldschermen is er één elektronenkanon aanwezig. Op de plaats waar de elektronenstraal het fluorescentiescherm treft, gaat dit oplichten met een intensiteit die evenredig is met de sterkte van de elektronenstraal. De elektronenstraal wordt door het afbuigingsmechanisme razendsnel (horizontale lijnen die elkaar verticaal opvolgen) over het volledige scherm gestuurd. Op die manier ontstaat een beeld. En een fractie van een seconde later is er al een nieuw beeld gevormd. Kleurenbeeldschermen bevatten drie elektronenkanonnen, één voor elke kleur (blauw, rood, groen).

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 4
LCD-beeldscherm (Liquid Crystal Display) De werking berust op het effect dat de vloeibare kristallen (LC: liquid crystal = materiaal dat zich in een toestand bevindt die eigenschappen van vaste kristalfase en vloeibare fase in zich verenigt) in het scherm in staat zijn om de polarisatierichting van licht te draaien als er een elektrische spanning op wordt gezet. Wanneer de lichtstraal het polarisatiefilter passeert wordt alleen het licht met één specifieke polarisatierichting doorgelaten: gepolariseerd licht. Vervolgens passeert dit gepolariseerd licht via de glasplaat het LC, waardoor de polarisatierichting verandert door de gedraaide structuur van het LC. Via de tweede glasplaat komt het licht bij een tweede polarisatiefilter dat ook alleen licht doorlaat met één bepaalde polarisatierichting. Wanneer dit overeenkomt met de polarisatierichting van het licht uit de LC, dan zal er dus een hoeveelheid licht door de lcd-cel gaan en kan de waarnemer een opgelicht punt zien. Wordt er een spanningsverschil op de LC-laag aangelegd, dan wordt de gedraaide structuur van de LC-moleculen verstoord en zullen ze zich allemaal richten. De polarisatierichting van het licht zal nu niet veranderen en de lichtstraal zal dus het tweede filter niet kunnen passeren: de waarnemer ziet een zwart punt. Een combinatie van enorm veel van deze (al of niet opgelichte) punten (pisels) levert dan het beeld. Plasmascherm (PDP = Plasma Display Panel) Een plasmascherm werkt zoals de tl-buis. In een afgesloten ruimte zorgt een elektrische spanning ervoor dat een geïoniseerd gas (een zogeheten plasma; in plasma-schermen meestal bestaand uit neon of een neon-helium-mengsel) licht geeft. In het plasmascherm worden evenwijdig lopende koperen draden aangebracht. Vlak daarboven ligt een tweede laag met koperen draden die loodrecht op de daaronder liggende draden staan. Een beeldpunt op een plasmascherm ontstaat doordat er een spanningsverschil wordt aangebracht op één onderliggende draad (kathode) en één draad in de tweede laag (anode). Dat beeldpunt ontstaat op het kruispunt van de twee draden. Per beeldpunt moeten dan, om een kleurenscherm te krijgen, nog eens drie basiskleuren kunnen weergeven worden.

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 5
Men verwachtte dat de massa van het atoom recht evenredig met het aantal protonen moest toenemen. Dit bleek niet het geval. Daardoor veronderstelde men dat er nog andere niet-geladen massadeeltjes in het atoom moesten voorkomen. Men noemde deze deeltjes neutronen. In 1932 kondigde Chadwick aan dat hij het bestaan van neutronen experimenteel kon aantonen.
James Chadwick 1891-1974
Experiment van Chadwick
De α-deeltjes5 stoten ongeladen deeltjes (neutronen) uit het beryllium. Die neutronen zorgen ervoor dat er protonen vrijkomen uit de paraffine. Die protonen worden op hun beurt gedetecteerd door flitsjes op de fluorescerende plaat.
Elementaire deeltjes
Symbool Lading6 Massa7
Elektron e -1 0,000549 u Proton p +1 1,007276 u Neutron n 0 1,008665 u
Atoommodel van Rutherford-Bohr
Joseph J. Thomson
1856-1940
Atoommodel van Thomson Volgens Thomson (±1900) bestaat een atoom uit een massieve bol positief geladen materie (protonenmassa), waarin negatief geladen deeltjes zitten (elektronen). Vandaar de populaire uitdrukkingen zoals het watermeloenmodel, het krentenbroodmodel, het plumpuddingmodel.
Atoommodel van Thomson
Lord Ernest Rutherford
1871-1934
Ontdekking van de atoomkern Rutherford zag in het beschieten van een dun (0.0004 cm) goudblaadje de mogelijkheid de kennis van het atoom uit te breiden of de bevestiging te krijgen van het bestaande model van Thomson. Rutherford meende dat zijn afgeschoten projectielen (α-deeltjes) op de massieve metaalatomen zouden terugkaatsen. Bij de proefnemingen bleek dat op honderdduizend projectielen er slechts 1 tot 5 werden teruggekaatst. De rest vloog er recht door of werd afgebogen. Dit leidde tot een nieuw model.
Experiment van Rutherford
5 α-deeltjes zijn positief geladen heliumkernen. 6 Lading t.o.v. de elementaire lading 1,6.10-19 C. 7 1 u = 1,66.10-27 kg.

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 6
Bijna alle massa is geconcentreerd in de kern (diameter slechts het 1/100000 van die van het gehele atoom): massarijke protonen en neutronen. De elektronenmantel is een grote ijle ruimte met daarin rond de kern bewegende elektronen. De draaiende beweging is nodig opdat anders de elektronen op de kern zouden vallen.
Niels Bohr 1885-1962
Postulaten van Bohr Waterstofgas, opgesloten in een glazen buis onder zeer lage druk, zendt paars licht uit bij (elektrische) excitatie. Dit licht blijkt te bestaan uit 4 verschillende golflengtes (kleuren): het (zichtbare) lijnenspectrum van waterstof. Bohr verklaarde dit fenomeen door aan te nemen dat het elektron in de elektronenmantel slechts welbepaalde energieën kon bezitten. Door opname van energie kon dat elektron naar een hoger energieniveau verhuizen, maar bij terugkeer naar het oorspronkelijke niveau werd die energie terug uitgestraald onder de vorm van licht met een welbepaalde golflengte.
Spectroscopie
Postulaten van Bohr
Hoofdenergieniveaus – Hoofdkwantumgetal nnnn De elektronen kunnen zich overeenkomstig de kwantumtheorie slechts op bepaalde hoofdenergieniveaus (schillen) bevinden waar ze geen energie uitstralen. Wanneer een elektron overgaat van een hogere naar een lagere schil gebeurt dit door het uitzenden van straling met een golflengte en een frequentie overeenkomstig de energie van de uitgestuurde straling. Volgens Bohr waren er zeven schillen. Hij noemde ze K- , L- , M- , … , Q-schil. De nummers van de schillen noemen we nu hoofdkwantumgetallen
n (1 , 2 , … , 7).
Nevenkwantumgetallen en subniveaus Bij spectroscopisch onderzoek van andere gassen dan waterstofgas (waterstof is het eenvoudigste atoom, met slechts één elektron) bleken de spectra véél meer lijnen te bevatten, meer dan mogelijk volgens de energie-overgangen tussen de schillen. Het vermoeden rees dan ook dat er meer energieniveaus mogelijk waren dan Bohr oorspronkelijk dacht (7). Nader onderzoek leverde onderstaande resultaten op.

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 7
Subniveaus
Nevenkwantumgetal llll De hoofdenergieniveaus, uitgezonderd het eerste, bevatten een aantal subniveaus waarvan de energieën lichtjes verschillen.
Hoofdniveau Subniveaus
Hoofdkwantumgetal
n Naam Aantal Naam
Nevenkwantumgetal
l
1 K 1 1s 0
2 L 2 2s 2p
0 1
3 M 3 3s 3p 3d
0 1 2
4 N 4
4s 4p 4d 4f
0 1 2 3
5 O 5
5s 5p 5d 5f
0 1 2 3 4
6 P 6
6s 6p 6d 6f
0 1 2 3 4 5
7 Q 7
7s 7p 7d 7f
0 1 2 3 4 5 6

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 8
Magnetische kwantumgetallen en banen
Bij verder spectroscopisch onderzoek bleek dat er in het spectrum veel meer lijnen waar te nemen waren als er een zeer sterk magneetveld ingeschakeld werd rond de buis met het gas. Hieruit werd geconcludeerd dat de elektronen in een bepaald subniveau verschillende banen konden volgen, die, als gevolg van hun oriëntatie, anders beïnvloed werden door het magneetveld. Op sommige banen kregen de elektronen een iets hogere energie, op andere een iets lagere. Daardoor verschenen er meer lijnen in het spectrum, die echter verdwenen van zodra het magneetveld werd uitgeschakeld. Enkel in een magneetveld hadden die elektronen dus een verschillende energie.
Magnetische niveaus of banen - Magnetisch kwantumgetal mmmmllll
In elk subniveau hebben de elektronen een aantal banen ter beschikking. Elektronen die verschillende banen volgen in een bepaald subniveau hebben alle dezelfde energie (tenzij in een sterk magneetveld).
Subniveau Aantal banen Magnetische kwantumgetallen
s 1 0 p 3 -1 , 0 , +1 d 5 -2 , -1 , 0 , +1 , +2 f 7 -3 , -2 , -1 , 0 , +1 , +2 , +3

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 9
Pieter Zeeman 1865-1943
Zeemaneffect – Spin van het elektron – Spinkwantumgetal Zeeman stelde vast, mede door het feit dat hij kon beschikken over een spectroscoop met hoge resolutie, dat de lijnen in het spectrum, dat opgenomen werd in een magneetveld, een dubbelstructuur vertoonden: het waren twee lijntjes zéér dicht bij elkaar (tot dan toe waargenomen als één lijn: doubletstructuur. Hij verklaarde dit door aan te nemen dat in elke baan (magnetisch niveau) twee elektronen konden bewegen, die een antiparallelle spin vertoonden: ze tolden rond hun eigen as in tegengestelde zin.
Spin van het elektron - Spinkwantumgetal mmmmssss
In elke baan (magnetisch niveau) kunnen maximaal twee elektronen. Ze hebben een antiparallelle spin.
Golfmechanisch atoommodel – Orbitaalmodel
Louis-Victor de Broglie
1892-1987
Dubbelspleetexperiment Op grond van het feit dat elektronenbundels eigenschappen van het licht vertoonden, meende de Broglie dat deze uiterst kleine bewegende deeltjes een golfkarakter moesten vertonen. Zijn vermoedens werden bevestigd o.a. door het dubbelspleetexperiment. Bij dit experiment wordt een elektronenbundel afgevuurd naar een metalen plaat waarin zich twee spleten bevinden. In locaties A verwachten we een grote elektronendichtheid. Er worden daar echter praktisch geen elektronen waargenomen. In locatie B, waar we de elektronen helemaal niet verwachten, is echter de elektronendichtheid het grootst. Elektronen gedragen zich precies als watergolven (rimpeltank) en licht. Ze vertonen een golfkarakter. Voor de beschrijving van dit driedimensionale golfverschijnsel heeft men beroep gedaan op de golfmechanica. Dit heeft geleid tot de beroemde Schrödinger-vergelijking die het verloop weergeeft van de amplitude Ψ (psi) van de golfbeweging in functie van de energie van het atoom.
In het golfmechanisch model beschouwt men het elektron niet als een snel bewegend materiedeeltje, maar wel als een energiegolf (vergelijk met radiogolven) die men op bepaalde plaatsen rond de kern gewaarwordt. De ruimte rond de kern waarin men het elektron voldoende sterk gewaarwordt, noemt men een orbitaal8.
8 Binnen een orbitaal is de gewaarwordingsintensiteit van het elektron niet overal even groot!

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 10
Elektronen in een s-subniveau zijn te voelen in alle mogelijke richtingen rond de kern. Een s-orbitaal heeft de vorm van een bol.
Elektronen in een p-subniveau hebben een preferentiële richting: volgens die richting is de gewaarwording van het elektron het grootst. p-orbitalen hebben de vorm van een halter. In elk p-subniveau zijn er drie halters, elk gesitueerd volgens een as van het rechthoekige assenkruis.
1.2. Elektronenconfiguratie
In het Periodiek Systeem van de Elementen (PSE) vinden we de symbolen van alle elementen terug, samen met enkele belangrijke gegevens. Atoomnummer Z (Rangnummer , Plaatsnummer , Protonengetal)
Het atoomnummer geeft het aantal (positieve) protonen in de kern weer. Het aantal (negatieve) elektronen in de elektronenmantel is daaraan gelijk, want een atoom is elektrisch neutraal. Symbool van het element
Atoomnummer Z = aantal protonen in de kern = aantal elektronen in de elektronenmantel. De elektronen zijn volgens een bepaald stramien verdeeld over de verschillende niveaus en banen. Hierbij moet slechts één regel in acht genomen worden: regel van de minimale energie. Er zijn geen elektronen aanwezig in een bepaald subniveau als niet alle voorgaande subniveaus opgevuld zijn. In een bepaald subniveau wordt eerst één elektron in elke baan/orbitaal geplaatst (de verschillende banen/orbitalen hebben immers dezelfde energie) alvorens elektronenparen te vormen (twee elektronen in dezelfde baan/orbitaal plaatsen vergt energie): regel van de maximale multipliciteit. (Regel van Hund) De twee elektronen in een zelfde baan/orbitaal hebben een tegengestelde spin. (Pauli-verbod: In een atoom komen geen twee elektronen voor met vier gelijke kwantumgetallen. Dat heeft voor gevolg dat in een baan/orbitaal maximaal twee elektronen met tegengestelde spin kunnen voorkomen.)

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 11
Energievolgorde van de subniveaus De subniveaus moeten dus volgens stijgende energie-inhoud opgevuld worden. Dit lijkt zeer eenvoudig, maar de realiteit is iets meer ingewikkeld. Door het feit dat het energieverschil tussen de hoofdniveaus afneemt hebben sommige subniveaus van een hogere schil een lagere energie-inhoud dan sommige subniveaus van een lagere schil. Het energieschema vind je hieronder links. Het is belangrijk om deze volgorde te kennen. Een hulpmiddel daarvoor vind je hieronder rechts.
Dit levert volgende elektronenconfiguraties op:
1H 1s1
2He 1s2
3Li 1s2 2s
1
4Be 1s2 2s
2
5B 1s2 2s
2 2p
1
6C 1s2 2s
2 2p
2
7N 1s2 2s
2 2p
3
8O 1s2 2s
2 2p
4
9F 1s2 2s
2 2p
5
10Ne 1s2 2s
2 2p
6
11Na 1s2 2s
2 2p
6 3s
1
12Mg 1s2 2s
2 2p
6 3s
2
13Al 1s2 2s
2 2p
6 3s
2 3p
1
We schrijven eerst de naam van het subniveau (1s), gevolgd door het aantal elektronen in het subniveau (1), geschreven als een exponent.

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 12
14Si 1s2 2s
2 2p
6 3s
2 3p
2
15P 1s2 2s
2 2p
6 3s
2 3p
3
16S 1s2 2s
2 2p
6 3s
2 3p
4
17Cl 1s2 2s
2 2p
6 3s
2 3p
5
18Ar 1s2 2s
2 2p
6 3s
2 3p
6
19K 1s2 2s
2 2p
6 3s
2 3p
6 4s
1
20Ca 1s2 2s
2 2p
6 3s
2 3p
6 4s
2
21Sc 1s2 2s
2 2p
6 3s
2 3p
6 3d
1 4s
2
Enkele elementen hebben een afwijkende configuratie, o.a.:
24Cr 1s2 2s
2 2p6 3s2 3p6 3d4 4s2 ⇒ 1s2 2s
2 2p6 3s2 3p6 3d5 4s1
29Cu 1s2 2s
2 2p6 3s2 3p6 3d9 4s2 ⇒ 1s2 2s
2 2p6 3s2 3p6 3d10 4s1 Deze afwijkende configuratie wordt verklaard door aan te nemen dat halfgevulde en volledig gevulde subniveau extra stabiel zijn:
Het zijn de elektronen, of beter, de elektronenverdelingen van de buitenste schil die de chemische eigenschappen van een atoom bepalen. Onder buitenste schil verstaan we de verzameling van subniveaus met hoogste hoofdkwantumgetal.
De gewaarwording van de elektronen rond de kern kunnen we met een orbitaal voorstellen. Deze
orbitalen verschillen in afmetingen naargelang de waarde van n. Hoe groter het hoofdkwantumgetal,
hoe uitgestrekter het orbitaal. Op die manier krijgen de atomen een ruimtevormelijk karakter en krijgen we meer inzicht omtrent de ruimtelijke structuren van atomen.
Na het 3p-subniveau volgt niet het 3d- maar wel het 4s-subniveau (lagere energie-inhoud).
Na het 3p-subniveau volgt het 4s-subniveau dat we eerst opvullen. Nadien volgt het 3d-subniveau. Nochtans schrijven we (bij voorkeur) het 4s-niveau achteraan, zodat de subniveaus van een zelfde hoofdniveau gegroepeerd blijven. Dit biedt in veel gevallen bepaalde voordelen.

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 13
Voorbeeld
34Se 1s2 2s
2 2p6 3s2 3p6 3d10 4s2 4p4
1.3. Elementen en isotopen
De massa die we in het PSE bij elk element terugvinden is de gemiddelde relatieve atoommassa van alle isotopen, rekening gehouden met hun procentueel voorkomen in de natuur. Van het element chloor bijv. komen er in de natuur twee atoomsoorten (nucliden) voor. Beide hebben uiteraard hetzelfde atoomnummer (Z = 17) en ze hebben beide dus 17 protonen in de kern en 17 elektronen in de elektronenmantel. Nochtans is de massa van het ene nuclide iets groter dan die van het andere nuclide.
Kern 17 protonen en 18 neutronen
= 35 nucleonen
17 protonen en 20 neutronen =
37 nucleonen Massagetal
Nucleonengetal A
35 37
Voorstelling 35Cl17 of
35Cl
37Cl17 of 37Cl
Ongeacht waar de chloor vandaan komt of hoe we hem bereiden, steeds hebben 75,4 % van de nucliden een massagetal A = 35 en 24,6 % van de nucliden een massagetal A = 37. De gemiddelde massa die in de tabel vermeld staat is dan ook 35,45:
35 * 75,4 + 37 * 24,6= 35,45
100
Een nuclide is een atoomsoort met een welbepaald aantal protonen en neutronen. Gaat het om nucliden van een zelfde elementensoort dan kan men de term isotopen9 of isotope nucliden gebruiken. Dus atomen met dezelfde plaats in het P.S. of atomen met een zelfde Z en een verschillende A noemt men isotopen. Van alle elementen bestaan twee of meer isotopen.
9 De term isotoop is van Griekse oorsprong en betekent gelijke plaats (isos = gelijk ; topos = plaats).

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 14
Element Waterstof Koolstof
Voorstelling 1H1 2H1 3H1 12C6
14C6
Kern 1 proton 1 proton 1 neutron
1 proton 2 neutronen
6 protonen 6 neutronen
6 protonen 8 neutronen
Elektronenmantel 1 elektron 1 elektron 1 elektron 6 elektronen 6 elektronen Protium Deuterium D Tritium T
Koolstofdatering
De isotope nucliden van koolstof (12C6
en 14C6
)
komen in een constante verhouding voor in het koolstofdioxidegas dat in onze atmosfeer aanwezig is. Dus ook in het koolstofdioxidegas dat de groene planten opnemen bij de fotosynthese en in de stoffen die zij daarbij produceren (suikers, zetmeel, …). En dus ook in het voedsel dat planteneters gebruiken. En dus ook in alle levende organismen (herbivoren, carnivoren, omnivoren).
Na afsterven en dus verbreken van de CO2-
uitwisseling met de atmosfeer neemt het
gehalte aan 14C6
in het materiaal af door
radioactief verval: 14 14 0C N + e (of β)
7 -16→
De halveringstijd van 14C6
bedraagt 5736 jaar.
Door in het afgestorven organisme (fossiel) de verhouding tussen beide isotopen te meten en die te vergelijken met de verhouding in de atmosfeer, kan men de ouderdom van het fossiel bepalen. De methode heeft een bereik van zo'n 50.000 jaar10.
10 De methode gaat ervan uit dat de 14C6 /
12C6 -verhouding in de atmosfeer in de loop der tijden onveranderd is gebleven.
Voor de laatste vijftig jaar is dit in elk geval onjuist. De verhouding is afgenomen en neemt nog steeds af ten gevolge van de
massale vorming van CO2 door verbranding van fossiele (dus 14C6 -arme) energiedragers. Deze afname wordt een beetje
gecompenseerd door de kunstmatige aanmaak van 14C6 door de proeven met kernwapens en lozingen van kerntechnische
installaties.

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 15
Radio-isotopen
Een radio-isotoop is een isotoop die niet stabiel is, maar straling uitzendt. Daarbij ontstaat vaak een isotoop van een ander element. (Radioactief verval) Sommige radioactieve kernen (met een grote halfwaardetijd) komen van nature op aarde voor (235U en 238U 40K). Andere radioactieve kernen (met een kleine halfwaardetijd) worden voortdurend aangemaakt (isotopen van radon door verval van andere langlevende radio-isotopen , 14C door kosmische straling). αααα-verval α-straling is een van de meest voorkomende vormen van ioniserende straling. Een alfadeeltje bestaat uit twee protonen en twee neutronen en is dus een heliumkern. α-deeltjes zijn gevaarlijk als ze inwerken op weefsel: ze brengen daarin chemische reacties teweeg. α-deeltjes zijn echter gemakkelijk tegen te houden: een blad papier volstaat.
α-Stralers zijn daarom eigenlijk alleen gevaarlijk als ze in het lichaam worden opgenomen, bijvoorbeeld wanneer men α-stralers via het voedsel of via injectie naar binnen krijgt. Eenmaal in het lichaam kunnen zij in hun directe omgeving grote schade aanrichten omdat alle energie die vrijkomt bij hun verval zich in een klein gebied om de vervallende kern concentreert. Een andere besmettingsweg is de blootstelling aan gasvormige α-stralers, zoals radon, dat ingeademd kan worden en dus veel gevaarlijker is. De sterk ioniserende α-straling raakt de binnenkant van de longen en kan daar veel schade aanrichten. Bovendien zijn de vervalproducten niet meer vluchtig en zetten zich daarom af in de longen. Ook die vervalproducten zijn op hun beurt weer radioactief. Een ander voorbeeld van een α-straler die door inademing gevaarlijk wordt is polonium-210, een radioactieve isotoop die in sigarettenrook voorkomt.
-4 4X Y + -2 2
A AZ Z
α→ 238 234 4U Th + 92 90 2
α→
ββββ-verval
β-straling is ioniserende straling, bestaande uit elektronen of positronen (dit zijn positief geladen elektronen).
Bij β--straling verandert in de kern een neutron in een proton,
waarbij een elektron wordt weggeschoten.
0X Y + e ( )+1 -1
A AZ Z β −→
170 170 0 - -Tm Yb + e (β )-169 70
→ (halfwaardetijd 458 y)
Bij β+-straling verandert in de kern een proton in een neutron,
waarbij een positron wordt weggeschoten.
In november 2006 kwam de isotoop 210Po in het nieuws, nadat de
voormalige Russische geheimagent Alexander

Chemie Interactief Light Leo Bergmans & Julien Van paemel
Atoommodel 16
0X Y + e ( )-1 +1
A AZ Z β +→
21 21 0 + +Na Ne + e (β )11 +110
→ (halfwaardetijd 23 s)
γγγγ-straling
γ-straling ontstaat vaak door radioactief verval van atoomkernen. In zuiver gammaverval verliest de atoomkern alleen energie in de vorm van een foton. Atoomnummer en massagetal blijven gelijk.
0X X + 0
A AZ Z γ→
99m 99Tc Tc + 43 43
γ→ (halfwaardetijd = 6 uur)
Radio-isotopen worden vaak gebruikt in de geneeskunde (radiodiagnose, radiotherapie).