Cel-cel communicatie in de neuro-glio- vasculaire eenheid tijdens...
Transcript of Cel-cel communicatie in de neuro-glio- vasculaire eenheid tijdens...
Cel-cel communicatie in de neuro-glio-
vasculaire eenheid tijdens inflammatie
Alexander Parmentier
Verhandeling ingediend tot
het verkrijgen van de graad van
Master in de Biomedische Wetenschappen
Promotor: Dr. Marijke De Bock
Begeleidster: Valérie Van Haver
Vakgroep Medische basiswetenschappen
Academiejaar 2014-2015
Cel-cel communicatie in de neuro-glio-
vasculaire eenheid tijdens inflammatie
Alexander Parmentier
Verhandeling ingediend tot
het verkrijgen van de graad van
Master in de Biomedische Wetenschappen
Promotor: Dr. Marijke De Bock
Begeleidster: Valérie Van Haver
Vakgroep Medische basiswetenschappen
Academiejaar 2014-2015
“De auteur en de promotor geven de toelating deze masterproef voor consultatie beschikbaar te
stellen en delen ervan te kopiëren voor persoonlijk gebruik. Elk ander gebruik valt onder de
beperkingen van het auteursrecht, in het bijzonder met betrekking tot de verplichting uitdrukkelijk
de bron te vermelden bij het aanhalen van resultaten uit deze masterproef.”
Datum
(handtekening student) (handtekening promotor)
(Naam student) (Naam promotor)
VOORWOORD
Het schrijven van het voorwoord, het leukste moment van de thesis. Dit betekent dat ik mijn
thesis tot een goed einde heb gebracht. Het heeft veel zweet, koffie en slapeloze nachten gekost,
maar het is gelukt. Het is de bekroning op m’n universitaire studies en een eerste kijk in de
wereld van het onderzoek. Het was super tof om na al die jaren met mijn hoofd in de boeken te
zitten eindelijk eens de theorie om te zetten in de praktijk.
Daarom zou ik graag mijn Promotor Dr. Marijke De Bock bedanken. Zonder haar was dit
allemaal niet mogelijk geweest. Beide geen vroege vogels, maar steeds tot de laatste in het labo.
Ze leerde me vele technieken, kon me steeds motiveren en had oneindig veel geduld wat ze zeker
nodig had met mij. Het was echt leuk om van zo’n spontane, goedlachse persoon te mogen leren.
Ook wil ik mijn begeleidster Valérie Van Haver en de andere onderzoekers van het labo
bedanken voor de tips en extra uitleg bij de technieken en toestellen.
Verder wil ik mijn medestudenten bedanken voor alle steun tijdens de lange dagen en voor de
ambiance en afleiding tijdens de vele uurtjes in de studentenkamer.
Mijn vriendin Astrid Roelant wil ik speciaal bedanken. Ze stond altijd klaar om naar mij te
luisteren wanneer ik het even moeilijk had. Ze gaf me ook de moed om niet op te geven.
Tenslotte wil ik nog mijn ouders, broer en vrienden bedanken voor al hun steun.
INHOUDSTAFEL
LIJST AFKORTINGEN ....................................................................................................................
SAMENVATTING .......................................................................................................................... 1
SUMMARY ..................................................................................................................................... 2
1. INLEIDING ................................................................................................................................. 3
1.1 Introductie ............................................................................................................................... 3
1.2 De bloed-hersen barrière en neuro-glio-vasculaire eenheid ................................................... 4
1.2.1 De functie van de BHB .................................................................................................... 6
1.2.2 Anatomie van de BHB: intercellulaire juncties ............................................................... 7
1.2.3 De rol van Calcium in de regulatie van de BHB ............................................................. 8
1.3 Connexines ............................................................................................................................. 9
1.3.1 Structuur en functie .......................................................................................................... 9
1.3.2 Cx43 ............................................................................................................................... 11
1.3.3 De rol van connexines in endotheliale Ca2+ signalisatie en BHB permeabiliteit.......... 11
1.4 Regulatie van BHB en Ca2+ kanalen in inflammatoire omstandigheden ............................. 12
1.5 Matrix metalloproteinasen .................................................................................................... 14
1.5.1 Regulatie van BHB permeabiliteit door MMPs ............................................................. 16
1.6 Doel van de studie ................................................................................................................ 19
2. MATERIALEN EN METHODEN ............................................................................................ 20
2.1 Celcultuur ............................................................................................................................. 20
2.1.1 Cellen splitsen en uitzaaien ............................................................................................ 20
2.1.2 Celcultuur opstarten ....................................................................................................... 21
2.1.3 Invriezen van cellen ....................................................................................................... 21
2.1.4 Geconditioneerd medium aanmaken .............................................................................. 21
2.2 Hemikanaal assay ................................................................................................................. 22
2.3 Gap junctie koppeling studie ................................................................................................ 23
2.4 Immuunkleuring ................................................................................................................... 24
2.5 Gelelektroforese en Western Blotting .................................................................................. 25
2.5.1 Cellysaten maken ........................................................................................................... 26
2.5.2 Eiwitconcentratie bepalen .............................................................................................. 27
2.5.3 SDS-PAGE .................................................................................................................... 27
2.5.4 Western Blot en immunodetectie ................................................................................... 28
2.6 Zymografie ........................................................................................................................... 29
2.7 Ca2+ -metingen ...................................................................................................................... 31
2.8 Statistische analyse .............................................................................................................. 32
3. RESULTATEN .......................................................................................................................... 33
3.1 Detectie van MMPs na blootstelling aan LPS ...................................................................... 33
3.1.1 Gelatine Zymografie ...................................................................................................... 33
3.1.2 SDS-PAGE en Western Blot ......................................................................................... 34
3.2 Effect van LPS en MMPs op Cx43 expressie in BHB endotheel RBE4 cellen blootgesteld
aan MMPs ................................................................................................................................... 36
3.3 LPS-CM stimuleert gap junctionele koppeling en hemikanaal activiteit in RBE4 cellen. .. 37
3.3.1 Effect van LPS-CM op gap junctionele koppeling ........................................................ 37
3.3.2 Effect van LPS-CM op hemikanaal activiteit ................................................................ 38
3.4 LPS-CM stimuleert Ca2+ dynamiek in RBE4 cellen ............................................................ 39
3.5 Effect van LPS-CM op expressie en lokalisatie van Cx43, Cx37 en Cx40 .......................... 40
3.6 Batimastat stimuleert gap junctionele koppeling en hemikanaal opening na directe
blootstelling aan LPS .................................................................................................................. 41
4. DISCUSSIE ................................................................................................................................ 43
4.1 Doel van de studie ................................................................................................................ 43
4.2 LPS activeert en verhoogt MMP (-2, -9 en -7) expressie ..................................................... 43
4.3 Effect van LPS en MMPs op Cx43 expressie in BHB endotheel RBE4 cellen blootgesteld
aan MMPs ................................................................................................................................... 44
4.4 LPS-CM stimuleert gap junctionele koppeling en hemikanaal activiteit in RBE4 cellen. .. 45
4.5 LPS-CM stimuleert Ca2+ dynamiek in RBE4 cellen ............................................................ 46
4.6 Batimastat stimuleert gap junctionele koppeling en hemikanaal opening na directe
blootstelling aan LPS .................................................................................................................. 47
REFERENTIES .............................................................................................................................. 47
ADDENDUM: SAMENSTELLING BUFFERS EN MEDIA ....................................................... 51
ADDENDUM: STRUCTUUR CHEMISCHE AGENTIA ............................................................ 55
LIJST AFKORTINGEN
6-CF 6-Carboxyfluoresceïne
ABC ATP-binding cassette
AJ adherens juncties
AM acetoxymethyl
ATP adenosine trifosfaat
BB-94 batimastat
BBB blood-brain barrier
BCIP 5-bromo-4-chloro-3-indolyl fosfaat
bFGF basic fibroblast growth factor
BHB bloed-hersenbarrière
BSA bovine serum albumin
Cbx carbenoxole
CSV cerebrospinaal vocht
CM geconditioneerde medium
Cx connexine
CZS centraal zenuwstelstel
DAPI 4’,6-diamidino-2-fenylindool
dH2O gedestilleerd water
DMEM dulbecco’s modified eagle medium
DMSO dimethylsulfoxide
EAE experimentele autoimmuunencephalitis
ECM extracellulaire matrix
ECn endotheelcellen
ER endoplasmatisch reticulum
ET-1 endotheline-1
FBS Fetal Bovine Serum
GJ Gap junctie
GJC Gap junctionele communicatie/koppeling
HBSS Hank's Balanced Salt Solution
HK hemikanalen
IL-1β interleukine-1 beta
IP intraperitoneaal
IP3 inositol-1,4,5-trifosfaat
ISV interstitieel vocht
JAM junctionele adhesiemolecule
LPS lipopolysaccharide
MAPK mitogen activated protein kinase
MLC myosin light chain
MMP matrixmetalloproteïnase
MW moleculair gewicht
NBT nitro blauw tetrazolium chloride
NF-κB nucleaire factor-κB
NO stikstofoxide
NGVU neuro-glio-vasculaire unit
ODDD oculodentodigitale dysplasie
PBS phosphate buffered saline
PDGF-B platelet-derived growth factor B
PLC fosfolipase C
PI propidium iodide
ROS reactive oxygen species
SDS-PAGE sodium dodecyl sulfate polyacrylamide gel electrophoresis
SLDT Scrape Loading and Dye Transfer
TGFβ transforming growth factor-β
TIMP tissue inhibitor of metalloproteinases
t-PA tissue plasminogeen activator
TJs tight juncties
TNFα tumornecrosefactor-alfa
TnI troponine I
ZO zonula occludens
1
SAMENVATTING
ACHTERGROND: Connexines (Cxs) komen sterk tot expressie in de cellen van de neuro-glio-
vasculaire eenheid. In endotheelcellen dragen ze bij tot de bloed-hersen barrière (BHB)
permeabiliteit door het stabiliseren van de tight juncties en door de vorming van een directe
communicatieroute voor Ca2+ via de gap juncties (GJ) of door paracriene signalisatie via
hemikanalen (HK). Matrix metalloproteinases (MMPs) zijn actief tijdens inflammatie en ze kunnen
Cx43 in het hart beïnvloeden. METHODES: Lipopolysaccharide (LPS) afkomstig van gram-
negatieve bacterien werd gebruikt om inflammatie te stimuleren in geimmortaliseerde rat brain
endothelial (RBE4) cellen. Zymografie, SDS-PAGE/western blot en immunohistochemie werden
gebruikt om endotheliale Cxs (Cx43, Cx37, Cx40) en MMPs te detecteren. Functionele testen zoals
scrape loading and dye transfer (SLDT) en dye uptake werden uitgevoerd om de impact van MMPs
op gap junctionele communicatie (GJC) en HK activiteit in RBE4 cellen te testen. Ten slotte, omdat
[Ca2+]i een determinant is van BHB permeabiliteit en aangezien Ca2+ signalisatie onveranderd
geassocieerd is met Cxs werd Ca2+-beeldvorming gebruikt om de impact van MMPs op de
endotheliale Ca2+ dynamiek na te gaan. RESULTATEN: Extracellulaire MMPs, aanwezig in het
medium van RBE4 cellen behandeld met LPS, waren in staat Cx43 te beïnvloeden en hadden
positieve effecten op GJC en HK activiteit wat overeenkwam met hun invloed op de endotheliale
Ca2+ veranderingen. Deze effecten konden geïnhibeerd worden door het gebruik van batimastat
(BB-94), een breed sprectrum inhibitor. CONCLUSIE: MMPS zijn in staat om de BHB
permeabiliteit te beïnvloeden op een Ca2+-afhankelijk manier via hun interactie met Cx43.
2
SUMMARY
BACKGROUND: Connexins (Cxs) are widely expressed in the cells of the neuro-glio-vascular
unit. In endothelial cells they contribute to the blood-brain barrier (BBB) permeability by
stabilizing the TJs or by forming a direct route of communication for Ca2+ via the gap junctions or
trough paracrine signaling via hemichannels. MMPs are known to be active during inflammation
and could be able to influence Cx43 channels, as indicated in the heart. METHODS:
Lipopolysaccharide (LPS) from gram-negative bacteria was used to stimulate inflammation in
immortalized rat brain endothelial (RBE4) cells. Zymography, SDS-PAGE/western blot and
immunohistochemistry were used to detect endothelial Cxs (Cx43, Cx37, Cx40) and MMPs.
Functional tests like scrape loading and dye transfer (SLDT) and dye uptake were performed to
assess the impact of MMPs on gap junctional communication (GJC) and hemichannel activity in
RBE4 cells. Finally, since [Ca2+]i is an known determinant for the BBB permeability and Ca2+
signaling is invariably associated with Cx channels, Ca2+-imaging was used to study the impact of
MMPs on endothelial Ca2+ dynamics. RESULTS: Extracellular MMPs, present in the medium of
RBE4 cells treated with LPS, were able to influence Cx43 and had positive effects on the GJC and
hemichannel activity what corresponded with their influence on endothelial Ca2+ changes. These
effects were inhibited by the use of batimastat (BB-94), a broad-spectrum MMP inhibitor.
CONCLUSIONS: MMPs are able to influence BBB permeability in a Ca2+ dependent manner via
their interaction with Cx43.
3
1. INLEIDING
1.1 Introductie
De hersenen en het ruggenmerg zijn de controle centra van het lichaam. Ze verwerken sensoriële
input, reguleren motorische output en coördineren vele van de individuele en gezamenlijke
activiteiten van weefsels. Neuronale signalisatie in het centraal zenuwstelsel (CZS) is strikt
afhankelijk van actiepotentialen en neurotransmissie. Het in stand houden van een stabiele micro-
omgeving waarin neurotransmissie effectief verloopt is de belangrijkste functie van de bloed-
hersenbarrière (BHB) (1-5). De BHB maakt op hoger niveau deel uit van de neuro-glio-vasculaire
eenheid (NGVU). Deze omvat neuronen, een extracellulaire matrix (ECM), pericyten en gliale
cellen (1-6). De BHB is een hoog selectieve barrière die op een strikte manier de passage van
moleculen in en uit het hersenweefsel controleert en zo de hersenhomeostase onderhoudt (1, 2, 4,
6). Deze barrière-functie is een combinatie van een transport barrière (specifieke
transportmechanismen die instaan voor een vaste flux), een metabole barrière (enzymen die
moleculen in transit metaboliseren) en een fysische barrière (2, 3). De basis van deze fysische
barrière zijn de intercellulaire juncties, nl. de tight juncties (TJs) en de adherens juncties (AJs) die
de intercellulaire ruimte tussen de capillaire ECn sterk vernauwen en zorgen voor een erg lage
paracellulaire permeabiliteit en hoge elektrische weerstand over de BHB (1, 2, 4, 6). Het
junctionele complex tussen de BHB-ECn bevat eveneens connexines (Cxs), een belangrijke
junctionele partner die vaak over het hoofd gezien wordt m.b.t. de cerebrale barrières (1, 7-10).
Cxs maken significant deel uit van het junctionele complex en stabiliseren de intercellulaire
juncties waardoor ze bijdragen aan de barrière functie (1, 6). Hun primaire functie is het vormen
van gap juncties (GJ), dit zijn kanalen die het cytoplasma van naburige cellen met elkaar verbinden
en die de passage van kleine hydrofiele moleculen (<1,5 kDa) mogelijk maken, wat zeer belangrijk
is in het coördineren van weefselfuncties, ook in de NGVU (1, 7, 11). GJ kanalen zijn grote, weinig
selectieve, waterige poriën die ontstaan door het dokken van 2 halve GJ kanalen of hemikanalen
(HKn), elk behorend tot één van de partner cellen. De HKn bestaan elk uit 6 Cx eiwitten, geordend
rond een centrale porie (1, 7-10, 12). Waar GJs een directe communicatieroute vormen tussen
cellen, zorgen HKn voor contact tussen het cytosol en de extracellulaire ruimte en vormen zo zowel
een autocriene als paracriene signalisatie route (1, 12). Tijdens neuroinflammatie, wat optreedt bij
verscheidene aandoeningen van het CZS, verliezen de ECn hun barrière functie. Het exacte
mechanisme is echter nog niet goed gekend. De meeste cellen van de NGVU kunnen pro-
4
inflammatoire cytokines vrijstellen die het junctionele complex beïnvloeden en zo de permeabiliteit
van de barrière verhogen (3, 5, 6, 12). De endotheliale cytoplasmatische Ca2+ concentratie ([Ca2+]i)
is onveranderlijk geassocieerd met dysfunctie van de barrière (1, 5, 6). HKn zijn op verschillende
manier gelinkt aan de [Ca2+]i. HKn zijn Ca2+ permeabele kanalen die openen tijdens inflammatie
in respons tot een verhoogde [Ca2+]i (10, 13) en daarmee bijdragen tot een Ca2+-geïnduceerde
BHB dysfunctie. Open HKn mediëren ook de diffusie van ATP, wat via de activatie van purinerge
receptoren, fosfolipase C (PLC) en tenslotte inositol 1,4,5 trisfosfaat (IP3), leidt tot vrijstelling van
Ca2+ uit het endoplamatisch reticulum (ER). GJs kunnen IP3 rechtstreeks doorgeven aan naburige
cellen en zo een lokale, Ca2+-geïnduceerde BHB dysfunctie, verspreiden en amplificeren. Dit toont
aan dat tijdens inflammatie de Ca2+ dynamiek, hand in hand met de Cxs, de BHB functie beïnvloedt
(1, 6, 10). Het aantal ziektes zoals Parkinson, Alzheimer (12) en epilepsie (3, 10) waarbij BHB
ontregeld is blijft toenemen. Een beter inzicht in de rol van Cx kanalen in de BHB tijdens
inflammatie is dan ook noodzakelijk. In deze thesis zal meer specifiek gekeken worden wat de rol
is van Matrix metalloproteïnasen (MMPs) op de Cxs in het barrière endotheel. MMPs worden
eveneens vrijgesteld tijdens neuroinflammatie en beïnvloeden de BHB integriteit (4, 14). Ze
verhogen de permeabiliteit onder andere door degradatie van de ECM eiwitten (15-17) en van TJ
eiwitten (15). Recent is er een eerste evidentie dat Cx43 een mogelijk substraat is van MMP-7 (16)
en MMP-2 (17). Tevens is aangetoond dat in pathologische condities Cx43 expressie daalt en dat
dit correleert met een stijging in MMP expressie (18). Deze data zijn echter allemaal afkomstig van
het hart en over de link tussen Cx43 en MMP is in het CZS nog weinig geweten. Baserend op de
data afkomstig uit het hart plus het feit dat Cxs belangrijke modulatoren zijn van de BHB
permeabiliteit zowel in fysiologische als pathologische condities, laten toe af te vragen wat de rol
is van MMPs in de controle van Cx-gemedieerde BHB regulatie. Betere inzichten in de cel-cel
communicatie binnen de NGVU tijdens neuroinflammatie kunnen mogelijks leiden tot verhinderen
van BHB dysfunctie tijdens neuropathologieën. In de volgende hoofdstukken worden de
verschillende thema’s van deze thesis -BHB, Cxs en MMPs- verder toegelicht.
1.2 De bloed-hersen barrière en neuro-glio-vasculaire eenheid
De BHB bestaat uit endotheelcellen die de wand van de capillairen vormen (1-6). Het oppervlakte
van deze endotheelcellen vormt de grootste plaats voor uitwisseling van moleculen tussen het bloed
en het hersenweefsel (1, 3). Deze oppervlakte is 150 à 200 cm2g-1 weefsel en komt overeen met
een totaal uitwisselingsoppervlakte van 12 tot 18 m2 voor de gemiddelde mens (2). De
5
endotheelcellen van de BHB verschillen van de perifere ECn door een verhoogd aantal
mitochondriën, het ontbreken van fenestraties en minimale pinocytotische activiteit (1, 5). Ze
vormen een hoog gesofisticeerd junctioneel complex bestaande uit AJs en TJs die paracellulaire
diffusie van opgeloste stoffen verhinderen tussen het bloed en de hersenen. Echter, het huidige
concept van de BHB is veranderd van een puur anatomische, endotheliale barrière naar een
complex en dynamisch geheel bestaande uit BHB-ECn en de daarmee geassocieerde gliale cellen,
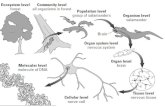
pericyten en neuronen dat men de NGVU noemt (1-6) (Fig 1).
Fig 1. De neuro-gliovasculaire eenheid. De NVGU is een
complex netwerk van cellen bestaande uit de endotheelcellen,
de pericyten, de astrocyten, neuron en microglia die samen de
BHB vormen (19).
De differentiatie van de endotheelcellen in het gespecialiseerde barrière-endotheel gebeurt tijdens
de angiogenese en wordt later vooral onderhouden door een dichte, inductieve interactie met
verschillende celtypes waaronder de astrocytaire eindvoetjes en pericyten (20, 21). Deze inductie
promoot bv. de op-regulatie van TJs (2). Transplant experimenten tonen mooi hoe de omgeving
van het endotheel de barrièrefunctie bepaalt. Cerebrale bloedvaten die getransplanteerd worden
naar perifeer weefsel worden minder restrictief, terwijl perifere bloedvaten die in het hersenweefsel
worden getransplanteerd juist veel restrictiever worden (22). Astrocytaire eindvoetjes omringen de
hersencapillairen bijna volledig, maar direct contact tussen deze structuren en het endotheel wordt
verhinderd door een basaal membraan wat pleit voor een paracrience signalisatie tussen de
astrocyten en de barrière (1, 2, 5). Alhoewel astrocyten noodzakelijk zijn voor het onderhoud van
de BHB, zijn ze waarschijnlijk niet voldoende om barrière eigenschappen te induceren (1, 5).
Sommige BHB karakteristieken zijn al aanwezig voor er gedifferentieerde astrocyten aanwezig
zijn. Daarom zijn neuronen of pericyten betere kandidaten om TJ formatie te induceren terwijl de
gliogenese overeenkomt met de veranderingen in TJ complexiteit (1). Pericyten staan in nauw
6
contact met de capillairen, zelfs in de vroegste stadia van ontwikkeling. Ze hebben een dendritische
morfologie met verschillende cytoplasmatische uiteinden die zich rond de wand van de capillairen
vasthechten (1, 2, 5) en ze zitten samen met de ECn in het basaal membraan waar zij de meeste
moleculaire componenten van synthetiseren (1). In tegenstelling tot astrocyten staan pericyten in
direct contact met de ECn (1, 2, 5). Pericyten reguleren groei en ontwikkeling van de bloedvaten,
alsook TJ formatie en transport functie via secretie van groeifactoren zoals transforming growth
factor-β (TGFβ) angiopoietine-1, platelet-derived growth factor B (PDGF-B) en basisch fibroblast
groei factor (bFGF) (1). Tenslotte maakt de ECM ook deel uit van de NGVU door interactie met
het cerebrale endotheel. Het verbindt laminine en andere matrix eiwitten met endotheliale integrine
receptoren die op hun plaats intracellulaire signaalcascades kunnen stimuleren. Matrix eiwitten
kunnen de expressie van TJ eiwitten beïnvloeden en hebben zo een ondersteunende rol in de BHB.
Disruptie van de ECM is sterk geassocieerd met een verhoogde BHB permeabiliteit in
pathologische toestanden (5), mogelijk doordat de anatomie van de NGVU, en daarmee de
trofische invloed van astrocyten en pericyten op het endotheel, wordt verstoord.
1.2.1 De functie van de BHB
De BHB verzorgt het CZS van een stabiele omgeving voor een optimale neurale werking (1-5). Ze
draagt bij aan de ionenbalans in het interstitieel vocht en zorgt er voor dat deze optimaal is voor
synaptische transmissie (2, 3, 5). Bloedplasma bevat hoge concentraties van het excitatoir
aminozuur glutamaat die fluctueren na ingestie van eten. Mocht glutamaat in een ongecontroleerde
wijze het interstitieel vocht (ISV) in de hersenen penetreren dan kan er een permanente
neurotoxische en neuroexcitatoire schade optreden aan neuronaal weefsel. Dit wordt bijvoorbeeld
ook geobserveerd in ischemische beroertes waarin verhoogde glutamaat concentraties in het ISV
leiden tot neuronale celdood (2, 3, 20). De BHB zorgt er tevens voor dat neurotransmitters die
zowel door het CZS als het perifeer zenuwstelsel gebruikt worden mooi gescheiden blijven (2, 3).
Verder verhindert de BHB dat macromoleculen in de hersenen terecht komen. Zo is de
eiwitconcentratie in het cerebrospinaalvocht (CSV) vele malen lager dan in het bloed. Plasma-
eiwitten zoals albumine, protrombine en plasminogeen zijn schadelijk voor het zenuwstelsel en
zorgen voor immuunactivatie van cerebrale cellen wat kan leiden tot apoptose en zenuwschade.
Het lekken van deze eiwitten naar de hersenen door een beschadigde BHB kan dus erge
pathologische gevolgen hebben (2). De BHB werkt als protectieve barrière door het beschermen
van het CZS tegen neurotoxische stoffen die in het bloed circuleren (2, 3, 5). Deze toxische stoffen
7
kunnen endogene metabolieten of eiwitten zijn, of stoffen ingenomen via de voeding. Het
volwassen zenuwstelsel heeft een minimale regeneratie capaciteit en gedifferentieerde neuronen
zijn niet in staat te delen en zichzelf te vervangen onder normale omstandigheden. Neuronen
sterven continu af vanaf onze geboorte gedurende ons hele leven, met weinig neurogenese. Elk
proces dat dit versnelt is nefast voor de gezondheid (2).
1.2.2 Anatomie van de BHB: intercellulaire juncties
Een zeer hecht junctioneel complex bestaande uit TJs en AJs tussen de cerebrale ECn is in zeer
sterke mate verantwoordelijk voor barrière functie. De extreem hechte TJs (zonulae occludentes)
tussen de endotheelcellen verhinderen niet alleen de paracellulaire diffusie van polaire stoffen van
het bloed plasma naar het extracellulair vocht van de hersenen (gate functie) (1, 2), maar ze
polariseren ook de cel (fence functie) (1). Ze zorgen voor een hoge transendotheliale elektrische
weerstand van ~ 1800 Ω cm2 (1, 2). De TJs bestaan uit de junctionele eiwitten occludine en claudine
en uit de junctionele adhesie molecules (JAMs) (1, 2, 5). Claudines zijn een familie van
transmembranaire eiwitten (20-24 kDa) waarvan er 24 isovormen geïdentificeerd zijn en ze zijn
het primaire barrière vormend onderdeel van de TJs (1, 5). In de bloedhersenbarrière zijn claudine
-3 en -5 de belangrijkste voor de vorming van de TJ structuur (1, 2). Occludine was het eerste
junctionele eiwit dat ontdekt werd (1), maar in contrast met claudines is het niet nodig voor de
vorming van het junctionele complex (1, 5). Desalniettemin is occludine expressie geassocieerd
met TJ sluiting en gecorreleerd met verhoogde elektrische weerstand (1, 5). Occludine wordt ook
vooral gevonden bij BHB endotheel en veel minder perifeer. Mature BHB ECn gebruiken
occludine vooral om hun barrière eigenschappen te reguleren i.p.v. ze tot stand te brengen (1). De
JAMs zijn een derde familie van transmembranaire eiwitten (1, 2, 5) die homo- en heterofiele
interacties mediëren in de TJ regio en zo de vroege aaneenhechting van naburige celmembranen
verwezenlijken (1). De oorzaak van de hoge elektrische weerstand van de BHB komt doordat de
TJs het ionentransport verhinderen. Dit benadrukt tevens hun effectiviteit die geregeld wordt door
de intracellulaire scaffold eiwitten ZO-1, ZO-2 en ZO-3 die de junctionele eiwitten occludine en
claudine linken via cingulin aan actine en het cytoskelet (2). Dit kan door directe interactie met
actine of indirect via binding met secundaire adapter eiwitten. Deze associatie is niet alleen
belangrijk voor stabilisatie van de juncties, maar ook voor de dynamische regulatie van junctie
opening en sluiting (1). In de AJs vormen cadherine eiwitten de intercellulaire brug en zijn ze in
het cytoplasma van de cel gelinkt aan de scaffolding eiwitten α, β en γ catenine die zelf gelinkt zijn
8
aan het actine cytoskelet en zo de het AJ complex stabiliseren (2, 5). De AJs houden de cellen
samen en geven het weefsel zo structurele stabiliteit. Ze zijn essentieel in de vorming van TJs (2,
13) en disruptie kan leiden tot BHB disruptie (2, 5). Verandering in intracellulaire en extracellulair
Ca2+ concentratie kan de AJ/TJ vorming moduleren en kan de elektrische weerstand over de cellaag
veranderen en de effectiviteit van de TJs als barrière verminderen (2, 13). De cellen van de NGVU
stellen vasoactieve agentia, cytokines (2) en MMPs (13) vrij die de vorming van de TJs en de
permeabiliteit van de BHB kunnen beïnvloeden.
1.2.3 De rol van Calcium in de regulatie van de BHB
Calcium ionen (Ca2+) spelen een belangrijke rol in de permeabiliteit van de BHB. Wanneer de
extracellulaire concentratie (~ 1 mM - 1,5 mM ) (23) verlaagt of de intracellulaire Ca2+ concentratie
([Ca2+]i; ~ 50-100 nM ) (23) verhoogt leidt dit tot verhoogde permeabiliteit (13). [Ca2+]i kan op
drie manieren worden verhoogd. Een eerste mechanisme is de vrijstelling van Ca2+ uit het
endoplasmatisch reticulum (ER), die 70 % van de celreserve aan Ca2+ bevat. Dit gebeurt wanneer
verschillende triggers zoals o.a. glutamaat (24), thrombine (25) of bradykinine (26) bindt op een
G-eiwit-gekoppelde receptor op het celmembraan van de cel. Deze activeert PLC, DAG en IP3 en
die laatste bindt op de IP3-receptor van het ER. Deze binding leidt dan tot de vrijstelling van Ca2+
uit het ER (27). Een tweede mechanisme waardoor de [Ca2+]i stijgt is door de influx van Ca2+
vanuit het extracellulair milieu via ionotrope receptoren (28). Deze mechanismen leiden tot een
verhoogde permeabiliteit of een daling van de TEER van hersenendotheelcellen zowel in vivo als
in vitro (13). Verder speelt de balans tussen de hechte intercellulaire juncties enerzijds en het
contractiele cytoskelet anderzijds een cruciale rol in de regulatie van de BHB permeabiliteit. Elke
verstoring van dit evenwicht zorgt voor een verhoogde diffusie over de barrière. Zo leidt de
verhoogde [Ca2+]i ook tot de activatie van een aantal effector eiwitten van signalisatiewegen die
een invloed hebben op deze intercellulaire juncties en/of op het cytoskelet en beïnvloeden ze zo
dus de BHB permeabiliteit. Bijvoorbeeld de myosin light chain (MLC), deel van het myosine motor
eiwit dat op zijn beurt deel uitmaakt van het cytoskelet, is in staat gefosforyleerd te worden.
Wanneer deze gefosforyeerd wordt door een MLC kinase op een Ca2+-afhankelijke manier leiden
de actine-myosine interacties tot een verhoogde contractiliteit van het cytoskelet en de vorming
van stress vezels en verhoogde BHB permeabiliteit (29). Een ander voorbeeld is dat de ROS-
productie geassocieerd is met een CaM-afhankelijke activatie van het mitogen activated protein
kinase (MAPK), wat leidt tot de redistributie van occludine en ZO-1 (30). Naast de [Ca2+]i speelt
9
ook de extracellulaire [Ca2+] concentratie een rol in de permeabiliteit van de BHB (31, 32). Zo zou
een daling van extracellulaire [Ca2+] een directe invloed hebben op de TJs en de endotheliale
permeabiliteit verhogen in een [Ca2+]i-onafhankelijke manier. Echter is dit effect wel secundair
aan de disruptie van de cadherines. Een daling van extracellulair [Ca2+] daling leidt tot disruptie
van de cadherines waardoor de TJs losser zijn. Belangrijk is dat de extracellulaire concentratie aan
Ca2+ minder belangrijk is dan [Ca2+]i m.b.t. de BHB permeabiliteit. Wanneer intracellulaire
effectormoleculen worden geïnhibeerd, dan doet dit de verhoogde permeabiliteit t.g.v. de daling
aan extracellulaire Ca2+ concentratie teniet (13). Toch is het onwaarschijnlijk dat enkel korte
termijn [Ca2+]i elevaties voldoende zouden zijn voor lange termijn BHB alteraties. Herhaalde
[Ca2+]i spike activiteit zijnde [Ca2+]i oscillaties zijn meer geneigd om langere effecten te
veroorzaken in de functie van de BHB (6). Zo zijn [Ca2+]i oscillaties aangetoond in BHB
endotheelcellen in respons tot bradykinine, ATP, hypoxie, endotheel-leukocyt interacties of invasie
van bacteriën (6).
1.3 Connexines
1.3.1 Structuur en functie
In het junctionele complex is er naast de TJs en AJs nog een 3e junctionele partner die vaak niet
vermeld wordt omdat deze juncties niet als functie hebben paracellulaire diffusie te verhinderen,
maar vooral betrokken zijn in de directe communicatie tussen naburige cellen (1) (zie 1.4.2). Het
betreft hier de Cx eiwitten die behoren tot een superfamilie met 21 isovormen (1, 7, 9, 12, 33).
Deze worden geëxpresseerd in een weefsel-specifieke manier (1, 7, 33) en krijgen hun naam
volgens hun moleculair gewicht (1, 7, 11, 12). Cxs hebben sterk geconserveerde transmembranaire
en extracellulaire regio’s en ze delen allemaal dezelfde architectuur. Ze bestaan uit 4
transmembranaire hydrofobe aminozuurregio’s, twee extracellulaire lussen en drie
cytoplasmatische componenten (een N-terminale regio, een C-terminale regio en een
cytoplasmatische lus) (7, 9, 33) (Fig2). Cxs komen voor in een hexamere configuratie in het
plasmamembraan, maar in tegenstelling tot TJ en AJ vormen deze geen dichte afsluiting tussen de
cellen (1). Ze verzorgen een directe communicatieroute tussen de cellen door het vormen van GJ
kanalen die het cytoplasma van naburige cellen verbinden. GJ kanalen zijn grote, zwak selectieve,
waterige poriën die ontstaan door de interactie van 2 halve GJ kanalen of hemikanalen (HK) (HK
docking), elk afkomstig van één van de partner cellen (1, 7-12, 34). HK bestaan elk uit 6 Cx eiwitten
10
geschikt rond een centrale porie die de passage mogelijk maakt van stoffen die kleiner zijn dan
~1,5kDa (1, 7, 11). Deze stoffen omvatten o.a. adenosine trifosfaat (ATP), ADP, glutamaat,
glutathione en boodschapper moleculen zoals cAMP en inositol 1,4,5-trisfosfaat (IP3) (11, 12).
Fig 2. Structuur Connexines. Een Cx eiwit bestaat uit 2 extracellulaire lussen en één intracellulaire lus. Tevens bevat
het een N- en C- terminaal deel die zich ook intracellulair bevinden. Zes Cx eiwitten vormen samen 1 hemikanaal
(HK) dat de intracellulaire ruimte verbindt met de extracellulaire ruimte. Een GJ wordt gevormd tussen twee HKn van
naburig gelegen cellen.
CxHK docking gebeurt in gespecialiseerde regio’s in de plasma membraan die men GJ plaques
noemt en die gevonden worden in bijna elk celtype van zoogdieren (1). CxHK zelf vormen een
strikt gereguleerde verbinding tussen het cytoplasma en het extracellulair milieu. Men dacht
oorspronkelijk dat CxHK gesloten bleven tot interactie met een naburig HK en vorming van een
GJ. Dit zou celdood verhinderen die ontstaat door het verlies van essentiële metabolieten, energie
substraten en diffundeerbare boodschapper moleculen en door het verlies van ionische gradiënten.
Echter, korte en gecontroleerde opening van de CxHK leidt niet tot celdood, wat impliceert dat
cellen tot op een bepaalde hoogte kunnen omgaan met een opening van de CxHK (1). Vandaag is
bekend dat CxHK kunnen geactiveerd worden door inflammatoire omstandigheden (12) en door
verschillende extra- en intracellulaire triggers zoals veranderingen in de intra- en extracellulaire
Ca2+ concentratie (10, 13), metabole inhibitie of ischemie (8), vrije radicalen, de intracellulaire
redox potentiaal, en mechanische stimulatie zoals bijvoorbeeld fluid flow shear stress (1, 11). Waar
GJs een directe route van communicatie vormen tussen cellen en zo elektrische (10) en metabole
activiteit coördineren, zorgen CxHK voor de communicatie tussen intra- en extracellulaire
compartimenten en verzorgen ze een diffusieweg voor ionen en kleine moleculen (1, 12). CxHK
kunnen bijdragen aan autocriene en paracriene signalisatie via de vrijstelling van extracellulaire
boodschappermoleculen zoals ATP en glutamaat (1, 11, 12). Samen coördineren GJs en HKn
11
verschillende functies gaande van het cellulair tot orgaan niveau zoals ontwikkeling, differentiatie,
oncogenische transformatie en groeicontrole, celdood, inflammatie en intercellulaire
signaaltransmissie (33, 35). Cxs komen voor in het CZS waar ze vooral in gliale en vasculaire
cellen connecties maken, maar ze kunnen ook gevonden worden in neuronen (1, 35). Er zijn elf
subtypes in het CZS en hun expressie hangt af van celtype en stadia van ontwikkeling. Cxs zijn
betrokken bij essentiële functies van het CZS en aberrante Cx expressie kan bijdragen tot CZS
aandoeningen (1).
1.3.2 Cx43
Cx43 heeft een massa van 43kDa en is het meest abundante Cx in het menselijk lichaam (34). Zo
komt het o.a. sterkt tot expressie in het hart (16, 17), de huid en het het oog (7). Cx43 is tevens het
predominante GJ eiwit in het CZS waar het tot expressie komt in pre-mitotische, radiale gliale
cellen, mature astrocyten en vasculaire cellen (1) en een belangrijke rol speelt in vele aspecten van
de ontwikkeling en fysiologie van het CZS (7). Defecten in zowel Cx43 expressie als functie leiden
tot ernstige problemen. Homozygote Cx43 knockout (KO) muizen sterven bij geboorte, doch
voornamelijk door cardiovasculair falen (7). Specifieke endotheliale Cx43 KO veroorzaakt
hypotensie en bradycardie bij muizen (36). Een mutatie in het gap junction alpha 1 (GJA1) gen dat
codeert voor Cx43 leidt tot oculodentodigitale dysplasie (ODDD) dat naast de uiterlijke kenmerken
ook verscheidene defecten in het CZS met zich meebrengt (34). Zo zijn veranderingen in Cx43
expressie geassocieerd met neuronaal verlies, astrogliose, ischemie en autoimmune inflammatie
(7). Tenslotte speelt Cx43 een rol in een proces dat men bystander celdood noemt, waarbij er
verspreiding is van celdood van apoptotische cellen naar gezonde naburige cellen (7, 11, 12).
Hoewel een totale afwezigheid van GJ slecht zou zijn tijdens een ischemische beroerte, kan een
tijdelijke blokkade tijdens en na de beroerte gunstig zijn (7). Het is ook belangrijk te vermelden dat
naast het negatief effect van bystander celdood, Cx43 ook neuroprotectief kan zijn na een
neuropathologie (7). Zo kan bijvoorbeeld bij epilepsie de GJC bijdragen aan de verspreiden van
neuronale schade, maar tevens essentieel zijn voor bescherming van weefsel door de aanvoer van
energetische moleculen en de afvoer van toxische componenten (10).
1.3.3 De rol van connexines in endotheliale Ca2+ signalisatie en BHB permeabiliteit
Zoals hierboven beschreven wordt een stijging van [Ca2+]i in het BHB endotheel bewerkstelligd
door de activatie van G-eiwit gekoppelde receptoren op het membraan die o.a. glutamaat (24),
12
thrombine (25) en bradykinine (BK) (26) als agonist hebben. Stroomafwaarts van de Ca2+-
geactiveerde signaalcascaden wordt het actine/mysosine cytoskelet beïnvloedt wat aanleiding geeft
tot reorganisatie van TJ/AJs en de BHB permeabiliteit verhoogt (13). De BHB wordt niet beïnvloed
door een eenmalige stijging in [Ca2+]i maar door het ontstaan van Ca2+-oscillaties en Ca2+-golven
(37). De golven propageren over cellen op twee manieren. Enerzijds gebeurt het door directe
communicatie via GJs. Dit wordt bewerkstelligd door de diffusie van IP3 of Ca2+ zelf door de GJs.
Anderzijds kunnen de golven propageren via paracriene signalisatie. Hierbij diffundeert een Ca2+
mobiliserende boodschapperstof (voornamelijk ATP) naar het extracellulair milieu via geopende
HK en bindt het de G-eiwit gekoppelde receptoren van een naburige cel waardoor daar de [Ca2+]i
stijgt (13). Verhoogde [Ca2+]i en membraan depolarisatie leiden ook tot HK opening en vrijstelling
van ATP in de extracellulaire ruimte. Autocriene signalisatie van ATP kan ook [Ca2+]i verhogen
wat bijdraagt tot BHB dysfunctie. Ca2+ en IP3 kunnen zelf rechtstreeks diffunderen tussen naburige
cellen via GJs en zou verder [Ca2+]i en IP3 verhogen en de vrijstelling van ATP bevorderen bij
naburige cellen. Dit type van Ca2+ wave kan gestopt worden door GJ blokkers (10). BK is een
inflammatoir peptide dat [Ca2+] oscillaties en een verhoogde endotheliale permabiliteit veroorzaakt
(6). Deze oscillaties kunnen kunnen verhinderd worden door te interfereren met Cx kanalen door
gebruik te maken van carbenoxolone, Gap27, een peptide dat Cx37 en Cx43 mimeert en zo Cx
kanalen blokkeert en Cx37/43 down reguleren. Gap27 inhibitie van de oscillaties is snel (binnen
minuten) en werk met Cx hemikanaal (HK)-permeabele kleurstoffen toonde HK opening en
purinerge signalisatie aan in respons tot stimulatie met BK. Verder inhibeerde Gap27 de BK-
getriggerde verhoging van endotheliale permeabiliteit zowel in vitro als in vivo (6). Daar Ca2+ een
belangrijke rol speelt in regulatie van de BHB permeabiliteit en dat deze Ca2+ signalisatie sterk
gelinkt is aan Cxs (38, 39) kunnen we hieruit afleiden dat de Cxs een belangrijke rol spelen in
regulatie van de BHB permeabiliteit.
1.4 Regulatie van BHB en Ca2+ kanalen in inflammatoire omstandigheden
Inflammatie is een complexe reactie op beschadiging van weefsel waarbij plasma eiwitten,
leukocyten en bloedvaten betrokken zijn (40). In het CZS gaan inflammatie en neurodegeneratie
hand in hand bij talrijke neurodegeneratieve ziektes zoals Alzheimer (12, 41), Parkinson (12, 41)
en Huntington (12) waar pro-inflammatoire cytokines zoals TNF-α en IL-1β bijdragen aan
neuronale celdood. De inflammatoire trigger kan afkomstig zijn uit de periferie (bv. bij infectie) of
uit het CZS zelf (bv. door neurodegeneratie) en in beide instanties speelt de BHB speelt hierin een
13
belangrijke rol omdat ze een belangrijke cellulaire component bevat die aangetast wordt door pro-
inflammatoire agentia afkomstig van het bloed of het hersenparenchym (12). Het inflammatoire
fenotype van het BHB endotheel leidt vervolgens tot het verlies van barrière eigenschappen, wat
verder bijdraagt tot verstoorde neuronale functie (13). Wanneer de BHB integriteit aangetast is
zullen inflammatoire cellen (zoals leukocyten) en water de hersenen binnentreden wat leidt tot
neuronale celdood en oedeem (40). De inflammatoire mediatoren zijn cytokines, chemokines en
complement adhesiemoleculen die verder leiden tot de rekrutering en activatie van leukocyten (40).
Zo kan de leukocyt invasie in de hersenen bijdragen aan de pathofysiologie van epilepsie (42).
Leukocyten zijn op hun beurt in staat reactive oxygen species (ROS) te activeren die het cytoskelet
verstoren en cellulaire eiwitten oxideren (40). Cellen van het CZS zijn zeer gevoelig aan oxidatieve
stress door hun hoge zuurstof consumptie en lage antioxidante bescherming. Oxidatieve stress
treedt op tijdens herseninflammatie door blootstelling aan pathogenen en ischemische periodes.
Verhoogde reactieve stikstof spiegels zijn neurotoxisch en stijgen bij cellen onder metabole stress.
Verder leidt verhoogde ROS productie tot meer oxidatieve stress en verhoogde reactieve
stikstofverbindingen tijdens veroudering en in neurodegeneratieve ziekten (12). ROS is ook in staat
om MMPs te activeren (13, 43). Deze proteïnasen komen tot expressie tijdens inflammatie en
kunnen zo ook bijdragen aan verschillende neuropathologiën (44). Microglia, die ~12 % uitmaken
van de totale hersencellen zijn de residente macrofagen van het CZS. Hun activatie treed snel op
na hersenschade en ze spelen een belangrijke en gunstige rol in de aangeboren immuunrespons,
maar overactiviteit kan tevens neurotoxisch zijn (12). Ze kunnen communiceren met andere
hersencellen via extracellulaire signalen zoals cytokines en neurotransmitters maar zijn ook in staat
te direct te communiceren met elkaar via Cx43 GJs , die slechts tot expressie komen na blootstelling
aan inflammatoire triggers (45). Deze kunnen ook de [Ca2+]i verhogen en zo bijdragen aan de BHB
dysfunctie (13). Cx43 speelt ook een rol in de aangeboren immuniteit. Zo leidt de blootstelling van
pulmonaire endotheelcellen aan lipopolysaccharide (LPS) tot expressie en activatie van Cx43 die
bijdragen aan de rekrutering en aanhechting van neutrofielen (46).
14
1.5 Matrix metalloproteinasen
MMPs bestaan uit een familie van zink-bevattende endopeptidasen (4, 13, 40, 44). Ze zijn
voornamelijk gekend voor hun eigenschap om de ECM te klieven (17, 40). Er zijn meer dan 25
verschillende MMPs beschreven. Naast hun eigenschap van degradatie van de ECM eiwitten zoals
cytokines, chemokines, cel oppervlakte receptoren, groeifactoren en andere proteasen te activeren
en zo bij te dragen aan fundamentele processen zoals cel-proliferatie, differentiatie, adhesie,
migratie en apoptose (40, 44) zijn ze ook in staat een aantal bioactieve moleculen te processen (44).
Zo zijn ze bijvoorbeeld in staat om niet-matrix substraten te klieven zoals serpins, insulin-like
growth factor binding proteins, galectine-3, tachykinine peptiden, IL1, tissue factor pathway
inhibitor en FGF type I receptor (47). Tenslotte is nu ook bekend dat MMPs intracellulaire targets
hebben. Onderzoek naar hoe MMP-2 activatie leidt tot myocardiale dysfunctie zorgde voor de
ontdekking van intracellulaire substraten zoals troponine I (TnI) en myosin light chain-1 (MLC-1)
die belangrijk zijn voor de contractie van de hartspier (48). MMPs spelen ook een rol in
verschillende fysiologische processen zoals reproductie (49), embryogenese (50), angiogenese
(51), weefsel remodulering (52) en verschillende aspecten van immuniteit en inflammatie (40, 53).
Op basis van hun substraatspecificiteit worden MMPs ingedeeld in 5 groepen: collagenasen (MMP-
1,-8 en -13) (51), gelatinasen (MMP-2 en -9), stromelysines (MMP-3,-10 en -11), matrilysines
(MMP-7 en MMP-26) en membraan-geassocieerde (MT-MMPs) (40, 44, 48) (Fig3). Alle MMPs
delen 3 dezelfde domeinen. Ze bevatten een N-terminaal signaal peptide die instaat voor de secretie
van het enzym uit het endoplasmatisch reticulum (ER) en transport uit de cel. Naast het
signaalpeptide ligt een hydrofobisch propeptide domein dat een regulatorische functie heeft en zich
afschermt via cysteine van het naburig Zn2+ bevattend katalytisch domein. Het katalytisch domein
van de gelatinasen verschilt van andere MMPs omdat ze 3 fibronectine type 2-achtige domeinen
hebben die een collageen-bindend domein vormen, wat de binding en vervolgens klieving toelaat
van type 4 collageen of gedenatureerd collageen (gelatine). De matrilysines zoals MMP-7 bevatten
enkel de 3 basisdomeinen, namelijk het predomein, het prodomein en het katalytisch domein (48)
(Fig 3).
15
Fig 3. Structuur van MMPs. MMPs worden typisch ingedeeld volgens het substraat dat ze klieven. N-terminaal
bezitten ze een N-terminaal signaalpeptide (grijs) dat transport uit de cel mogelijk maakt. Alle MMPs die zich in de
latente fase bevinden bezitten tevens een cysteine domein die zich tussen het propetide (groen) en het katalisch domein
(roze) bevindt. Het katalytisch domein bevat een Zn2+ ion. Het katalytisch domein van de gelatinases is uniek omdat
het 3 fibronectine repeats bevat. Buiten de matrilysines hebben alle MMPs een flexibele scharnier regio die ook een
haemopexine domein bevat gelinkt aan een C-terminaal domein (48).
De transcriptie van MMPs wordt geregeld door cytokines en groeifactoren zoals interleukines (IL-
1, IL-4 en IL-6), transforming growth factor beta (TGFβ), tumor necrosis factor alpha (TNFα)
(54) en NFkβ (17). Hoewel ze het product zijn van verschillende genen hebben ze toch
gelijkaardige structurele en functionele elementen. MMPs komen tot expressie in zeer lage
hoeveelheid en in een latente vorm worden ze pro-MMPs genoemd (54). Door hun potentieel
destructieve eigenschappen als proteases worden MMPs oorspronkelijk gesynthetiseerd en
gesecreteerd in de extracellulaire ruimte als inactieve zymogenen, met een propeptide domein dat
gekliefd moet worden door andere proteasen zoals plasmine, weefsel plasminogeen activator (t-
PA) en urokinase-type plasminogeen activator (u-PA) of door MMPs zelf alvorens het enzym actief
is (40, 44). Men spreekt van een zogenaamde cysteine switch, die de interactie tussen cysteine in
het prodomein en het Zn2+ ion in de actieve site verstoord. Proteolytische verwijdering van het
doelwit in het prodomein door serine proteinases, furine of MMPs destabiliseert het propeptide en
verbreekt de Zn2+-cysteine interactie (40). De katalytische activiteit van de MMPs is gereguleerd
op verschillende niveaus zoals transcriptie, secretie, activatie en inhibitie (44). Inhibitie van MMPs
wordt gereguleerd door leden van de tissue inhibitor of metalloproteinases (TIMP) familie die 4
16
eiwitten omvat: TIMP-1 , TIMP-2, TIMP-3 en TIMP-4 (44, 55). MMPs in het CZS hebben ook
een duale rol. Het is zo dat ze schadelijk zijn bijvoorbeeld in de acute fase van een beroerte, maar
tijdens de herstel fase zouden ze een positieve rol kunnen vervullen. Dit kan verklaard worden door
hun oorspronkelijke functie tijdens de hersenontwikkeling waar ze de ECM modificeren om de
uitgroei van nieuwe cellen, waaronder neuronen met hun axonen en dendrieten mogelijk te maken
(4, 40).
1.5.1 Regulatie van BHB permeabiliteit door MMPs
MMPs worden vrijgesteld in het hersenweefsel en het bloed tijdens perifere en centrale inflammatie
(51, 56, 57). Tevens wordt de BHB opening vooral gemedieerd door de MMPs in neuroinflammatie
(53) . Bijvoorbeeld, de BHB ontregeling bij een beroerte of tijdens hersenschade wordt tot stand
gebracht door degradatie van ECM substraten die essentieel zijn voor een normale signalisatie en
homeostase binnen de NGVU (4, 44). In de context van neurovasculaire schade zullen MMPs de
basale lamina degraderen, de bloedvaten verzwakken en ze blootstellen aan lekken en scheuren.
Na een beroerte en in vele experimentele modellen van cerebrale ischemie zijn MMPs significant
verhoogd (44). Tevens is de eerste behandeling bij een beroerte trombolyse, wat als bijwerking
intracraniale bloedingen kan veroorzaken. De trombolyse met intraveneus recombinante t-PA zou
via activatie van MMPs aanleiding kunnen geven tot die zware bloedingen (4, 44). Zo kwam men
op het idee om de thrombolye via t-PA te combineren met een breed spectrum MMP-inhibitor
minocycline (44, 58), die makkelijk door de BHB kan. De resultaten zijn gunstig en twee
succesvolle eerste fase klinische trials zijn reeds afgerond (58). Men moet hierbij wel voorzichtig
zijn en de potentieel positieve effecten van de MMPs in gedachten houden. De mechanismen van
MMP-gemedieerde hersenschade zijn divers en komen ofwel direct door degradatie van hersen
matrix substraten of indirect door activatie van andere bioactieve moleculen (44). MMPs verhogen
de BHB permeabiliteit via de degradatie van endotheliale matrix eiwitten (15, 16, 59) zoals
laminine, heparan sulfaat en fibronectine (53) en door het klieven van TJs (13, 15, 59). Breed
spectrum MMP inhibitie verhinderd BHB permeabiliteit en oedeem vorming na een ischemische
periode door het verhinderen van ECM degradatie en TJs klieving (40, 59). Buiten de vasculaire
schade en lekken op zich, leidt de MMP gemedieerde proteolyse van de neurovasculaire matrix
ook tot verstoring van de architectuur en homeostatische signalisatie tussen de verschillende
celtypes van de NVGU. Zo is de matrix signalisatie via integrines vitaal voor een optimale normale
celfunctie in rust. Wanneer MMPs de ECM degraderen interfereren ze ook met trofische stoffen
17
zoals FGF en BDNF die belangrijk zijn voor de neuroprotectie tegen hypoxie, oxidatieve stress en
zelf amyloid-beta. Zo dragen ze dus ook bij aan pathofysiologie van ziektes zoals beroerte en
hersentrauma’s (4). Wanneer de cellen hun interactie verliezen met de ECM komen ze los en
worden ze minder levensvatbaar. Deze vorm van celdood is gekend als anoikis (40). Dit treedt op
in neuronen en cerebrale endotheelcellen tijdens disruptie van de ECM door MMPs (4). De MMPs
die het sterkst bijdragen aan BHB schade zijn de gelatinases A en B , namelijk MMP-2 en MMP-
9 respectievelijk (53). Zo toont een studie aan dat amyloid-β in cerebrale amyloid angiopathie
(CAA) verantwoordelijk is voor verhoogde BHB permeabiliteit door vermindering van TJ
proteïnes claudin-1 en claudin-5 wat geassocieerd is met een verhoogde expressie van MMP-2 en
MMP-9 (60). Ze zijn ook belangrijk in cardiovasculaire ziekten, waaronder atherosclerose,
beroerte, hartfalen, ischemie of een aneurysma (48). MMP-2 zorgt voor de initiële BHB opening
door klieving van claudine-5 (40, 53, 59) en occludine (40) wat leidt tot structurele veranderingen
in TJs. Hierdoor zijn de TJs minder hecht, maar ze blijven wel nog tussen de endotheelcellen zitten
en het proces is reversibel (40). Pro-MMP-2 expressie is geassocieerd met een verhoogde BHB-
permeabiliteit 3 en 48 uur na middel coronaire arterie occlusie (61). MMP-2 is ook in staat om de
vasculaire druk te beïnvloeden door zijn proteolytische invloed op vasoactieve peptides zoals big
endothelin-1 (ET-1), calcitonin gene-related peptide en adrenomedllin (48). MMP-2 kan de
leukocyt invasie beïnvloeden door het reguleren van signalisatie cascaden die verantwoordelijk
zijn voor de expressie van adhesiemoleculen. Bijvoorbeeld door het knippen van ET-1 kan MMP-
2 de expressie van integrine beïnvloeden omdat ET-1 de expressie van integrine beïnvloed via de
binding op de endotheliale A receptor op het oppervlakte van de neurtrofielen via de MAPK kinase
signalisatieweg. Zo draagt MMP-2 dus bij aan de leukocyt-endotheliale celadhesie en neutrofiel
transport naar de site van inflammatie (62). Echter de rol van MMP-2 in ischemische
hersenaandoeningen is controversieel aangezien MMP-2 deficiënte muizen niet beschermd zijn
tegen een beroerte. Zo zou MMP-9 het dominante protease zijn aangezien MMP-9 deficiënte
muizen weinig verlies van BHB permeabiliteit hebben en een beperkte hersenschade vertonen (40).
Tijdens de secundaire BHB opening is de opregulatie van MMP-9 geassocieerd met de volledige
degradatie van TJs in de interendotheliale spleet (40). MMP-9 verstoort de BHB door disruptie
van de TJs via degradatie van occludine en ZO-1 (40, 60). MMP-9 wordt opgereguleerd in zowel
ischemishe als inflammatoire condities. Endotheel cellen, microglia en astrocyten brengen MMP-
9 tot expressie, maar ook neutofielen die het latente MMP-9 bevatten brengen het in de hersenen
18
tijdens inflammatie (53). MMP-9 zou ook een belangrijke rol spelen in de leukocyt invasie
doorheen de BHB (63, 64). Zo ziet men bij MMP-9 KO muizen een gedaalde leukocyt infiltratie
in de BHB en een verminderde adhesie van de leukocyten aan de endotheelcellen in vergelijking
met de WT muizen (64). Dit wordt bevestigd door de leukocyt infiltratie naar de hersenen tijdens
meningoencephalitis veroorzaakt door A.cantonensis bij muizen, wat geassocieerd is met een
verhoogde BHB permeabiliteit (63). Een verminderde cardiale functie met volume overload en
endocardiale endotheliale apoptose is ook geassocieerd met MMP-9 activatie (65). Bij honden met
canine visceral leishmaniasis is MMP-9 ook verhoogd wat leidt tot BHB disruptie (63). Tijdens
subarachnoidale bloeding gaat MMP-9 zorgen voor de degradatie van collageen type 4 wat leidt
tot een verhoogde BHB permeabiliteit (63). Er wordt hierboven vooral gefocust op de rol van
MMP-2 en MMP-9 m.b.t. tot de BHB permeabiliteit. Maar MMP-7 zou ook capabel zijn om
eiwitten te klieven die essentieel zijn voor BHB integriteit en immuunsupressie. In vitro, kan MMP-
7 ECM substraten klieven zoals collageen type 4, laminine en fibronectine en ook bioactieve
moleculen zoals TNFα en andere MMPs waaronder MMP-2 en MMP-9 (16). Er is ook aangetoond
in het hart dat het C-terminaal uiteinde van Cx43 een substraat is van MMP-7 (16). Verder is
gebleken bij experimentele autoimmuunencephalitis (EAE) bij muizen, een model voor MS dat
MMP-7 een rol zou spelen in de facilitatie van immuuncel penetratie in de perivasculaire ruimte.
Op deze manier is er naast MMP-9 ook een rol weggelegd voor MMP-7 in deze ziekte, wat nieuwe
therapeutische mogelijkheden biedt (66). MMP-9, MMP-2 en MMP-7 spelen dus alle 3 een rol in
de leukocyt invasie in de hersenen en dragen ook op deze manier bij tot BHB dysfunctie want de
leukocyten produceren glutamaat wat de BHB permeabiliteit verhoogt. Ook stellen inflammatoire
cellen zoals neutrofielen proteolytische enzymes vrij tijdens inflammatie. Er ontstaat dan een
onevenwicht tussen de proteases en de protease inhibitors. MMPs dragen bij aan dit onevenwicht
doordat ze in staat zijn de protease inhibitoren te inactiveren. Zo kan bijvoorbeeld MMP-9 de serine
elastase inhibitor, serpin α1-proteinase inactiveren (67). Verder is het belangrijk op te merken dat
BHB dysfunctie zich niet beperkt tot een open of toe fenomeen maar dat er gradaties zijn in de
BHB permeabiliteit die zich weerspiegelen in de cel-cel signalisatie binnen de NGVU (4). Deze
resultaten tonen mooi aan dat MMPs de BHB permeabiliteit verhogen door het klieven van de
ECM eiwitten en de TJs. Maar over de invloed van de MMPs op de Cxs in de BHB is nog zeer
weinig geweten. Daarom moet er onderzocht worden wat de rol is van de MMPs op de Cx-
gemedieerde regulatie van de BHB permeabiliteit.
19
1.6 Doel van de studie
Zowel Cxs als MMPs zijn belangrijke componenten in de regulatie van BHB permeabiliteit in
inflammatoire omstandigheden. Bovendien tonen recente studies aan dat Cx43 een substraat kan
zijn van MMPs. Deze data zijn echter vooral afkomstig van studies in het hart. Zo zou MMP-7 in
staat zijn Cx43 te klieven (16). Van een familie van meer dan 20 MMPs zijn MMP-2 en MMP-9
het sterkst aanwezig in de vroege en late stadia van chronisch hart falen (65). Resultaten in het hart
tonen aan dat Cx43 expressie gedaald zou zijn in TIMP-2 KO muizen in vergelijking met wild-
type muizen (55). In een hond model van ventriculair falen is Cx43 expressie eveneens gedaald en
is deze daling geassocieerd met een daling in TIMP-2 expressie (18). MMP-9 zou ook een
belangrijke rol spelen in renale vasculaire remodulering in muizen met diabetes (43). Renale Cxs
zouden de bloeddruk reguleren en zouden bijdragen aan de diabetische renale remodelering. Het
exacte mechanisme hoe ze dit doen is echter nog niet gekend (43). Hypoxie zou ook Cx43
dysreguleren door modulatie van MMPs via MAPK signalisatie (17). In deze thesis onderzoeken
we of Cx43 dat tot expressie komt in het BHB endotheel, een substraat is van MMP en of de
interactie tussen MMPs and Cx43 aanleiding geeft tot verhoogde endotheliale [Ca2+]i, wat leidt tot
BHB dysfunctie.
20
2. MATERIALEN EN METHODEN
2.1 Celcultuur
RBE4 cellen zijn rat brain endothelial cellen die groeien op collageen gecoate falcons bij 37°C en
5% CO2 en onderhouden worden in α-minimum essential medium (αMEM)/Ham’s F10 (1:1) dat
aangelengd is met 10% foetaal kalfserum, glutamine en geneticine, en 1µL/mL humaan
recombinant basische fibroblast groei factor. Cultuurmedia hebben als doel voldoende
voedingsstoffen en energie te leveren zodat de cellen buiten het organisme kunnen overleven en
delen. Het cultuurmedium bestaat uit 2 delen: een basaal medium, welke alle essentiële stoffen
bevat voor het cellulair metabolisme (fysiologische zoutoplossing, buffersysteem, energiebronnen,
aminozuren en vitaminen), en supplementaire componenten (eiwitten, serum en antibiotica) om
aan andere eisen te voldoen zoals deling en differentiatie. Aan media is meestal ook nog een pH
indicator toegevoegd (fenolrood) welke oranje-geel wordt bij een zure pH en paars in alkalisch
milieu. De cellen worden gegroeid in een CO2 incubator bij 37°C. Het doel van de incubator is een
omgeving te creëren waarin de pH, temperatuur en vochtigheid gecontroleerd zijn en ideaal voor
de cellen.
Materiaal
cultuurflesjes (TPP, Novolab, Geraardsbergen, België)
15 en 50 ml buisjes (Novolab)
multidish 4-wells (NuncTM, Nunclon delta Si, Roskilde, Denemarken),
Trypsine-EDTA (Invitrogen)
RBE4 Cultuurmedium (zie addendum)
DMSO (Dimethylsulfoxide) (Sigma-aldrich, Bornem, België)
2.1.1 Cellen splitsen en uitzaaien
Methode
- Laat de cellen groeien in een 5 ml cultuurflesje tot een confluente monolaag.
- Warm media en Trypsine-EDTA op in een warmwaterbad tot 37°C.
- Verwijder het medium boven de cellen.
- Breng 1.5 ml Trypsine-EDTA op de cellen.
- Incubeer 2 min bij 37°C.
21
- Controleer of de cellen zijn losgekomen onder de microscoop.
- Neutraliseer de Trypsine-EDTA door 3.5 ml medium toe te voegen en pipetteer op en neer.
- Splits volgens de gewenste densiteit
2.1.2 Celcultuur opstarten
- Haal de ampules uit de stikstoftank en ontdooi in een warmwaterbad bij 37°C.
- Breng alles uit de ampule over in 10 ml medium.
- Centrifugeer gedurende 1 min (500g).
- Zuig het bovenstaand medium af en voeg 5 ml vers medium toe aan de cellen.
- Breng de cellen over in een 25 cm2 cultuurflesje.
- Bewaar de cellen in de CO2 incubator
2.1.3 Invriezen van cellen
Methode
- Groei de cellen tot een confluente monolaag in twee grote cultuurflessen (75 cm2) gevuld
met 15 ml celmedium.
- Verwijder het celmedium door aspiratie.
- Maak de cellen los met 3 ml trypsine-EDTA.
- Inactiveer het trypsine door 12 ml medium toe te voegen.
- Voeg de inhoud van de cultuurflessen samen.
- Breng de cellen in een 15 ml buisje en centrifugeer (1 min aan 500g).
- Resuspendeer de cellen in 900 µl celmedium per ampule en voeg 100 µl DMSO toe.
- Incubeer de buisjes overnacht in isopropanol bij -80°C en breng ze vervolgens over in
vloeibare stikstof (-196°C).
2.1.4 Geconditioneerd medium aanmaken
Om het effect van MMPs op Cx expressie en Cx kanaalfunctie te onderzoeken worden levende
cellen rechtsreeks blootgesteld aan LPS of aan geconditioneerd medium (CM). Het CM is het
geïsoleerde medium gecollecteerd van cellen die aan bepaalde condities werden blootgesteld. Hier
gaat het om medium van cellen die op verschillende tijdspunten (3h, 6h en 24h) zijn blootgesteld
aan LPS (resp. LPS-CM(3h); LPS-CM(6h); LPS-CM(24h)). Vervolgens worden MMPs (samen
met alle andere componenten met een MW > 9kDa) geconcentreerd met behulp van de Pierce
22
Protein Concentrator. Dit is een 7mL kolom waarin er een cellulose membraan zit met een MW
cut-off van 9kDa. Wanneer deze kolom wordt gecentrifugeerd bij 4°C en 400g gedurende 5min
wordt meer dan 90 % van de eiwitten > 9kDa gescheiden van de kleinere.
Methode
- cellen uitzaaien tot ze confluent zijn
- het medium vervangen door serumvrij medium
- de cellen incuberen met LPS gedurende verschillende tijdspunten (3h, 6h en 24h) of vehikel
(controle).
- het CM na de incubatieperiode overbrengen in de Pierce Protein Concentrator
- het medium centrifugeren in de kolom gedurende 5min bij 4°C en met 400 g om het medium te
scheiden van het overgebleven celpellet.
2.2 Hemikanaal assay
Hiervoor worden EC gebruikt die subconfluent zijn om te vermijden dat de opgenomen kleurstof
wordt doorgegeven naar naburige cellen via GJs. De cellen worden geïncubeerd met de kleurstof
propidium iodide (PI, 2mM) die kan opgenomen worden door open HKn omdat de kleurstof een
MW < 1 kDa heeft. Daarna wordt PI weggewassen met HBSS-HEPES en wordt een kernkleuring
uitgevoerd met Hoechst. De stalen worden vervolgens geanalyseerd onder de
fluorescentiemicroscoop. Er kan nu een verhouding gemaakt worden tussen de PI gekleurde cellen
en het totaal aantal cellen. Er wordt gebruik gemaakt van een kwiklamp voor excitatie van de
kleurstoffen. Hoechst wordt belicht met UV licht (excitatie maximum is 350 nm) en PI wordt
gevisualiseerd met excitatiegolflengte 535 nm (TRITC).
Materialen
HBSS (Hank's Balanced Salt Solution) - HEPES (zie addendum)
Propidium iodide (PI) (Invitrogen)
Hoechst (Invitrogen)
Epifluorescentiemicroscoop (Nikon Eclips TE2000, Analis, Gent, België)
Met een fluorescentiemicroscoop is het mogelijk om fluorochromen te visualiseren. Dit zijn
moleculen die in staat zijn om licht van een bepaalde golflengte te absorberen en vervolgens terug
uit te zenden met een langere golflengte. De fluorescentiemicroscoop verschilt enkel van een
lichtmicroscoop doordat de lichtbron een kwiklamp is (Nikon S Fluor). Bij de
23
epifluorescentiemicroscoop komt het exciterende licht van opzij en wordt het met behulp van een
dichroïsche spiegel gefocust op het preparaat. Op die manier kan het exciterende licht, wat vaak
heel sterk is, de waarneming van het emissielicht niet bemoeilijken. Er wordt gebruik gemaakt van
2 filters, een excitatiebandpassfilter en een emissiebandpassfilter.
Methode
- 3 x wassen met HBSS-HEPES
- 10min incuberen met 2 mM PI in HBSS-HEPES
- 3 x wassen met HBSS-HEPES
- Hoechst-tegenkleuring doen in HPSS-HEPES (1/1000)
- Hoechst 10 min laten rusten in het donker
- Analyse onder fluorescentiemicroscoop (objectief x10)
2.3 Gap junctie koppeling studie
Bij Scrape Loading and Dye Transfer (SLDT) wordt er een scratch gemaakt met een naald in het
membraan van verschillende cellen waardoor die cellen permeabel worden voor een kleurstof die
aan de cellen wordt toegevoegd. Eerst worden de EC gewassen met een Ca2+-vrije buffer waardoor
de GJs openen. Vervolgens wordt de kleurstof 6–carboxyfluoresceine (0,4 mM) toegevoegd.
Daarna wordt een scratch gemaakt. De kleurstof heeft een laag MW (< 1 kDa) en kan dus
doorgegeven worden aan naburige cellen via GJs. Dit kan geanalyseerd worden onder de
fluorenscentiemicroscoop. Langs elke zijde van de scratch worden 7 opnames gemaakt met behulp
van de omgekeerde epifluorescentiemicroscoop uitgerust met een x10 objectief en filters voor
excitatie (492 nm) en emissie (517 nm) van 6-carboxyfluoresceine. Deze spreiding volgt een
exponentieel verloop waaruit de spatiale constante (1/K), een maat voor de spreiding, kan afgeleid
worden. Deze is representatief voor de mate van gap junctionele koppeling (GJC).
Fig 4. Beeldje van SLDT genomen
met een fluorescentiemicroscoop. Beeldje toont de verspreiding van de
fluorescente kleurstof langs de zijde
waar de scratch is gemaakt. De
fluorescentie wordt dan uitgezet tov
de afsand waaruit de spatiale
constante (1/K) kan berekend
worden. Dit is een maat voor GJC.
Scale bar is 100 µm (68).
24
Materialen
HBSS-HEPES (zie addendum)
SLDT Buffer (zie addendum)
SLDT Solution: SLDT buffer met 6–carboxyfluoresceine (0,4 mM; Invitrogen)
Epifluorescentiemicroscoop (zie hierboven)
Methode
- we laten de cellen groeien tot ze volledig confluent zijn en er GJs gevormd zijn
- 3 x wassen met SLDT buffer
- SLDT solution op de cellen brengen en de cellen 1min incuberen in deze oplossing
- Scratch maken met naald in de cultuur en de cellen 1min laten incuberen met SLDT solution
- 6 x wassen met HBSS-HEPES
- cellen 10 min laten rusten
- Analyse onder de fluorescentiemicroscoop
2.4 Immuunkleuring
Via immuunkleuring wordt gekeken naar de expressie en lokalisatie van Cxs. Cellen worden
uitgezaaid in multidish 4-wells. Wanneer de cellen confluent zijn worden ze 4h geïncubeerd met
LPS-CM. Daarna worden de cellen gefixeerd met 4% formol om het metabolisme stil te leggen.
Vervolgens wordt met behulp van de detergent 0,2 % Triton X100 het membraan van de cellen
gepermeabiliseerd. Dit is noodzakelijk opdat de antilichamen via de poriën in het membraan hun
doelwit kunnen bereiken. Aspecifieke bindingen worden verhinderd door gelatine. Vervolgens
worden de Cx43 (1/2000, Sigma Aldrich), Cx40 (1/50, Merck) en Cx37 (1/50, Gentaur) primaire
antilichamen (AL) toegevoegd. Het gebiotinyleerd secundair antilichaam (1/5) opgelost in gelatine
wordt hierna toegevoegd. Streptavidine (30 µg⁄ml) (1/400, Invitrogen) wordt toegevoegd voor de
visualisatie van de antilichamen onder de fluorescentiemicroscoop. Streptavidine is in staat
gebiotinyleerde biomoleculen zoals de antilichamen te binden voor de detectie onder de
fluorescentiemicroscoop. Finaal wordt DAPI (4’,6-diamidino-2-fenylindool) (1µg/ml) opgelost in
PBSD+ toegevoegd. DAPI is een membraan permeabele kleurstof die in staat is om alle kernen
van de cellen aan te kleuren.
25
Materialen
PBSD+ (phosphate buffered saline; zie addendum)
4% formaldehyde (Sigma-Aldrich)
0.2% Triton X100 in PBSD+ (Sigma-Aldrich)
Blokbuffer 2% gelatine (Sigma-Aldrich) in PBSD+
Alexa Fluor® 488 Streptavidine (Invitrogen)
DAPI (Life Technologies, excitatie max:350 nm, emissie max:470 nm)
Methode
- cellen spoelen met PBSD+
- 20 min incuberen met formol
- cellen spoelen met PBSD+
- 10 min cellen permeabiliseren met 0,2 % Triton X100, opgelost in PBSD+
- cellen spoelen met PBSD+
- cellen blokken met 2% gelatine (1/5), opgelost in PBSD+
- Primair AL toevoegen, 2uur
- cellen spoelen met PBSD+
- Secundair AL toevoegen, 2uur
- cellen spoelen met PBSD+
- Streptavidine (1/400) toevoegen, opgelost in PBSD+
- cellen spoelen met PBSD+
- DAPI toevoegen
- cellen spoelen met PBSD+ en erop laten staan
- visualisatie met BD pathway 435 microscoop (20x)
2.5 Gelelektroforese en Western Blotting
We gebruiken Western Blotting om na te gaan welke MMPs tot expressie komen in cellysaten en
CM. We gebruiken het ook om Cx43 te detecteren. De detectie gebeurt door gebruik te maken van
C-terminale polyclonale antilichamen geproduceerd in konijn (Sigma Aldrich; MMPs 1/1000;
Cx43 1/10000). De secundaire antilichamen zijn gekoppeld aan alkalisch fosfatase. Het maken
van cellysaten gebeurt m.b.v. RIPA lysebuffer. Daarna worden de lysaten gesonificeerd om de
eiwitten te fragmenteren. Dan wordt er voor het cellysaat (evenals het CM) per laantje een zelfde
26
hoeveelheid eiwit ingebracht (20-50 µg/laantje). Hiervoor moet eerst de concentratie van het eiwit
bepaald worden. Dit gebeurt aan de hand van de BioRad DC protein assay. Dit is een
colorimetrische methode waarbij de reactie gelijkaardig is aan de lowry assay. Deze assay is
gebaseerd op een reactie tussen de eiwitten, een alkalisch koper tartraat oplossing en foline reagens.
Koper wordt door tyrosine, tryptofaan en in mindere mate door cystine, cysteïne en histidine in het
lysaat gereduceerd, dit leidt vervolgens tot de reductie van het foline reagens met vorming van een
blauwe kleur. Deze blauwe kleur kent een maximale absorbantie bij 750 nm en een minimale
absorbantie bij 405 nm. Gelijktijdig met de lysaten meet men de absorbantie van een
standaardreeks met gekende concentratie van bovine serum albumin (BSA) in de gebruikte
lysebuffer. Dit laat toe een standaardcurve op te stellen, waarbij de absorbantie wordt uitgezet in
functie van de BSA-concentratie. De ongekende eiwitconcentratie van het lysaat kan uiteindelijk
met behulp van de standaardcurve en de gemeten absorbantie worden afgeleid. Nu de gewenste
eiwitconcentraties verkregen zijn kunnen de verschillende laantjes geladen worden en kan de
sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) gestart worden. SDS in
de polyacrylamide gel zorgt voor denaturatie van de eiwitten en zorgt ervoor dat ze een uniforme
negatieve lading krijgen waardoor enkel scheiding zal plaatsvinden op basis van MW. Na het lopen
van de gel gebeurt de transfer naar een nitrocellulose membraan (Blotting). Daarna worden de
primaire en secundaire antilichamen toegevoegd aan het membraan. Deze secundaire antilichamen
zijn gekoppeld aan alkalisch fosfatase. De detectie gebeurt met behulp van 5-Bromo-4-Chloro-3-
Indolyl phosphate (BCIP)/Nitroblue tetrazolium salt (NBT) (1:10 in dH2O; Invitrogen). BCIP is
een onoplosbaar substraat voor alkalisch fosfatase, dat na defosforylatie door NBT geoxideerd
wordt, resulterend in een donkerblauwe indigo neerslag op het membraan.
2.5.1 Cellysaten maken
Materialen
PBSD+ (zie addendum)
RIPA (radioimmunoprecipitation assay) buffer (zie addendum)
Celschrapers (Greiner, Sigma-aldrich)
Sonicator (LabsonicU, B.Braun, Bethlehem, PA, USA)
Methode
- verwijder medium
27
- was 3 x met PBSD+
- voeg 200 µL RIPA buffer toe aan de cellen die groeien in een 25 cm2 falcon
- schraap de cellen met de celschrapers en breng de cellen terug in een epje
- soniceer 30x (30 pulsen)
- bewaar lysaten bij -20°C
2.5.2 Eiwitconcentratie bepalen
Materialen
RIPA buffer (zie addendum)
BSA (Bovine Serum Albumin) stock: 20 mg/ml (Sigma-aldrich)
Eiwitlysaat (zie eerder)
BioRad DC Protein assay kit (BioRad, Hercules, CA, USA)
Reagens A: alkalische koper tartraat oplossing; Reagens B: Foline reagens; Reagens S: SDS
Microtiterplaat (Nunclon delta Si)
Plaatlezer VICTOR (Perkin Elmer)
Methode
Om een ijklijn te maken, wordt een standaardreeks gemaakt van BSA opgelost in RIPA.
Om de eiwitconcentratie te bepalen wordt de absorbantie gemeten bij
509 nm. Deze mengsels bevatten:
- 5 µl van één van de concentraties uit de standaardreeks of 5 µl eiwitlysaat.
- 25 µl A’ (A’ = 1 ml A + 20 µl S)
- 200 µl B
De plaatlezer VICTOR is in staat absorbantie, luminescentie en fluorescentie te meten. De well-
plaat zal 5 seconden schudden en absorbanties worden na 15 minuten incubatie uitgelezen.
Concentraties worden bepaald via de ijklijn die de absorbanties voor gekende concentraties BSA
weergeeft
2.5.3 SDS-PAGE
Materialen
RIPA buffer (zie addendum)
Reducerend agens (10x) (Invitrogen)
28
NuPAGE LDS (loading solution) sample buffer (5x) (Invitrogen)
NuPAGE precast gel (Invitrogen)
Gelhouder (Invitrogen)
Elektroforesecasette (Novex, Invitrogen)
Elektroforesetoestel (X Cell Sure Lock TM, Novex, Invitrogen)
NuPAGE MES SDS running buffer (20x) (Invitrogen)
NuPAGE antioxidans (Invitrogen)
Merker: See Blue Plus 2 (Invitrogen)
Centrifuge (Eppendorf AG, Hamburg, Duitsland)
Methode
- verdun het eiwit in een mengsel van reducerend agens, RIPA, en LDS
- de eiwitten 5min laten koken
- centrifugeer gedurende enkele seconden
- plaats de gel in de gelhouder en vul het binnenste compartiment met running buffer aangelengd
met antioxidans (500μL/200mL). Het buitenste compartiment wordt gevuld met de rest van de
running buffer
- breng de stalen aan in de slotjes van de gel
- leg de spanning aan. De elektroforese gebeurt op ijs opdat het gel niet zou smelten
2.5.4 Western Blot en immunodetectie
Materialen
Blotbuffer (zie addendum)
Blothouder (Invitrogen)
Sponsen (Invitrogen)
1 MM Whatmann papier (Biorad)
Nitrocellulose membraan Hybond C (Amersham Biosciences, Buckinghamshire, UK)
Blotcassette (X cell II TM Blot Module, Noves, Invitrogen)
Blotapparaat (X cell Sure Lock, Novex, Invitrogen)
Blokbuffer (zie addendum)
Antilichamen, verdund in blokbuffer.
BCIP/NBT Kit (invitrogen)
29
Methode
- Maak de volgende opstelling van anode (+) naar kathode (-):
sponsje/2 whatman papiertjes/ nitrocellulosemembraan/ gel/ 2 whatman papiertjes/sponsje
Zorg dat alles doordrenkt is met blotting buffer en klem tussen de 2 elektroden.
- Leg spanning aan (30V) gedurende 1h à 1h30. Ook de blotting gebeurt op ijs om de gel niet
te doen smelten.
- Incubeer het nitrocellulosemembraan gedurende 1h in blokbuffer bij kamertemperatuur.
- Incubeer het membraan met het primaire antilichaam gedurende 1h bij kamertemperatuur tot
overnacht bij 4°C.
- Was het membraan 3x met blokbuffer gedurende 15 min.
- Incubeer met het secundaire antilichaam 1 h bij kamertemperatuur.
- Was het membraan 3x gedurende 15 min met blokbuffer zonder melk.
- Incubeer het membraan in de substraatoplossing tot de bandjes zichtbaar worden
- Stop de reactie door de blots in dH20 te wassen
- Neem een foto en voer de procedure opnieuw uit met anti-Tubuline antilichaam,
- De analyse gebeurt via het programma ImageJ, waarmee de intensiteit van elk bandje gemeten
kan worden
- Finaal wordt er een verhouding gemaakt tussen de intensiteit van het eiwit van interesse met het
totaal aantal geladen eiwit (tubuline)
2.6 Zymografie
Gelatine zymografie wordt gebruikt om lysaten te analyseren op de aanwezigheid van MMPs. Bij
gelatine zymografie kunnen de verschillende gelatinase-MMPs bepaald worden door hun
onderling verschil in MW en afbraakcapaciteit voor gelatine. De eiwitstalen (15µL) plus een
merker (SeeBLue Plus2 Pre-stained Protein Standard) worden op een gelatine-bevattende gel
geladen en gelopen in het gel-elektroforese toestel op een gelijkaardige manier als voor Western
Blotting. Echter, nu wordt de gel niet geblot. Na het lopen van de gelatine gel wordt deze in
TritonX100 (TX100) geïncubeerd wat zorgt voor renaturatie van MMPs die vervolgens gelatine
zullen klieven. Hierna wordt de gel gefixeerd met behulp van een Developing buffer. Deze fixeert
gelatine dat gekliefd is in het membraan. Tenslotte wordt Coomassie blauw toegevoegd, gevolgd
door ontkleuring in azijnzuur/methanol om zo de gekliefde gelatine in de gel in beeld te brengen.
30
Aan de hand van de merker kunnen we de locatie van de bandjes analyseren en bepalen om welke
MMP het gaat.
Materialen
Running gel (zie addendum)
Stacking gel (5mL) (zie addendum)
Tris glycine SDS ladingsbuffer bromophenol Blue (Biorad)
Tris glycine SDS running buffer (10x) (zie addendum)
Renaturatie buffer (TritonX100) 2,5 % (Sigma Aldrich)
De gel wordt gelopen in het Novex systeem (zie boven)
Developing buffer (10x) (zie addendum)
Staining solution (zie addendum)
Destaining oplossing (zie addendum)
Methode
- Running gel gieten
- Isobutanol toevoegen om bubbels uit de gel te krijgen
- Stacking gel gieten wanneer de running gel gestold is
- Kammetje erin plaatsen en opnieuw laten stollen
- Stalen voorbereiden : staal + ladingbuffer 50/50 (max 15µL laden in totaal)
- Stalen centrifugeren
- Running buffer toevoegen in gel-ektroforese toestel
- Stalen en merker laden
- Gel laten lopen (90-125V)
- Eiwitten in de gel laten renatureren in TX100 (2,5%) gedurende 30min
- Renaturatie buffer vervangen door developing buffer gedurende 30min
- Developing buffer opnieuw vervangen voor 4u tot overnacht bij 37°C
- Developing buffer weggieten en 3 x wassen met dH20
- Kleuren met Coomassie Blauw voor 30min
- Ontkleuren met destaining oplossing tot de bandjes zichtbaar worden
- De visualisatie gebeurt met het blote oog en de klieving van gelatine door MMPs is duidelijk
zichtbaar als een wit bandje op de blauwe achtergrond
31
2.7 Ca2+ -metingen
De EC groeien op plastieke petridishes tot de gewenste confluentie. Daarna worden ze 4h
geïncubeerd met CM > 9 kDa die verschillende periodes werd blootgesteld aan LPS (1µg/mL). Het
laatste uur van incubatie met CM worden ze geladen met een mengsel van 10 µM fluo-4AM , 1mM
probenecid en 0,01% pluronic acid in HBSS-Hepes gedurende 1h bij KT. Daarna worden de cellen
gewassen met HBSS-Hepes/probenecid en gedurende 15 min bij KT in het donker gezet om te
deësterificeren. De cellen worden dan gevisualiseerd onder een omgekeerde epifluorescentie
microscoop, voorzien van een superfusie systeem die het mogelijk maakt om na ~1min het medium
te verversen met een Ca2+-vrije buffer om direct het effect van MMPs aanwezig in CM op de Ca2+
huishouding te bestuderen. Er wordt elke sec een beeldje genomen met een 40x water immersie
objectief en een elektron mutiplier CCD camera (Quantem 512SC;Photometrics, Tucson, AZ,
USA). Er wordt gebruik gemaakt van een Lambda DG-4 filterswitch om een excitatie van 482nm
te geven en om het geëmitteerd licht te vangen via een 505nm dichroïstische spiegel en een 535nm
bandpass filter. Opnemen en analyse gebeurt met een custum made QuantEMframes en Fluoframes
programma geschreven in Microsoft Visual C** 6.0. Ca2+ golven en oscillaties worden
gevisualiseerd in een 10 minuten observatie periode. De analyse gebeurt door een verhouding te
maken tussen het aantal oscillerende cellen (minstens 2 oscillaties) en de totaal aantal cellen
gedurende de observatie periode en door het tellen van het aantal golven.
Materialen
Plastic petridishes (Novolab, Geraardsbergen, België)
DMSO (Dimethylsulfoxide) (Sigma-aldrich, Bornem, België)
epifluorescentie microscoop (Eclips TE 300, Nikon Belux, Brussel)
40x water immersie objectief (NA 0,8)
HBSS-Hepes (zie addendum) + probenecid (1 mM) (Invitrogen)
Fluo-4AM (Life Technologies, Merelbeke, België)
0,01% pluronic acid (Invitrogen)
Methode
- Cellen 4h incuberen met CM (1/100) > 9kDa
- Na 3h cellen wassen met HBSS-HEPES-Probenecid
32
- Cellen 1h laden met mengsel 10 µM fluo-4AM , 1mM probenecid, 0,01% pluronic acid en CM
(1/100) opgelost in HBSS-HEPES
- Cellen wassen met HBSS-HEPES-Probenecid
- Cellen visualiseren onder microscoop
- Na 1min Ca2+-vrije buffer (zie addendum) toevoegen via perfusie systeem
- Gedurende 10min beeldjes opnemen
- Analyse gebeurt nadien met zelfgeschreven programma fluoframes
- Door middel van puntanalyse wordt elke cel geselecteerd en wordt de fluorescentieverandering
gedurende de volledig opname periode weergegeven
Een oscillerende cel wordt gedefinieerd als een cel die ten minste twee Ca2+ transiënten vertoont
na applicatie van de stimulus. Het aantal oscillerende cellen wordt uitgedrukt ten opzichte van het
totaal aantal cellen. Een Ca2+ golf wordt gedefinieerd als een stijging in de [Ca2+]i die tenminste
naar 1 naburige cel wordt doorgegeven. Bij een paracriene golf hoeven dit niet noodzakelijk twee
aan elkaar grenzende cellen te zijn. In dit geval wordt ook gekeken naar het tijdsinterval tussen de
[Ca2+]i stijgingen.
2.8 Statistische analyse
Data worden voorgesteld als het gemiddelde ± S.E.M. met n het aantal observaties. Statistische
significantie wordt bepaald aan de hand van een t-test voor gepaarde observaties of ANOVA
(analyis of variance) met Bonferonni post-test voor statistische vergelijking van meer dan twee
groepen. De data worden verwerkt met GraphPad Instat software. p-waarden < 0.05 worden als
significant aanzien(een symbool voor < 0.05, twee symbolen voor < 0.01, drie symbolen voor <
0.0001).
33
3. RESULTATEN
3.1 Detectie van MMPs na blootstelling aan LPS
3.1.1 Gelatine Zymografie
Als start van het experimenteel onderzoek werd nagegaan of MMPs aanwezig zijn in het lysaat en
het CM van RBE4 cellen die gedurende verschillende periodes (3h, 6h en 24h) werden blootgesteld
aan LPS (1 µg/mL) of vehicle (HBSS-Hepes). MMPs werden in eerste instantie gedetecteerd door
middel van zymografie waarbij er verschillende MMPs tegelijk kunnen worden gedetecteerd en
geïdentificeerd volgens hun moleculaire gewicht (MW) (Fig 5A). Dit is dan ook direct het grote
voordeel van deze techniek. In een gelatine zymogram zullen MMPs die behoren tot de klasse van
de gelatinasen (o.a. MMP-2, MMP-9 ) en het matrilysine MMP-7 in staat zijn gelatine, aanwezig
in de polyacrylamide gel, te klieven en zo een ‘signaal’ te produceren. Dit signaal is zichtbaar als
een wit bandje na aankleuring van de gel met coomassie blauw (Fig 5B-C). We hebben in deze
studie voornamelijk gefocust op de detectie van MMP-2 en MMP-9, twee MMPs die in belangrijke
mate bijdragen tot disruptie van de BHB in inflammatoire omstandigheden (4, 44, 59, 63) en de
detectie van MMP-7, een MMP dat minder wordt besproken in de context van BBB disintegriteit,
maar waarvan gekend is dat het een effect heeft op Cx43 (16). Gelatine zymografie van LPS-CM
toont signaal ter hoogte van 64-98kDa wat de aanwezigheid van (pro-)MMP-2 en (pro-)MMP-9
suggereert (Fig 5B).
Fig 5. Detectie van MMPs d.m.v. gelatine zymografie. A. MWs van de verschillende MMPs die onderzocht worden
in deze thesis. B. Gelatine zymografie van LPS-CM. De gelatine die aanwezig is in de gel vormt een substraat voor
het katalytisch domein van de MMPs. Het klieven van gelatine is zichtbaar als een wit bandje op een coomassie blauw-
aangekleurde gel. Bandjes ter hoogte van 98kDa en 64kDa suggereren de aanwezigheid van (pro)-MMP2 en (pro)-
MMP9 in het CM. C. Het scheiden van <9kDa en >9kDa fracties toont aan dat de MMPs zich concentreren in de
>9kDa fractie.
34
MMP-7 werd nooit gedetecteerd. Hoewel dit MMP wordt geacht gelatine te klieven (69), blijkt een
gelatine gel minder optimaal te zijn voor detectie van hiervan (i.t.t. een caseine gel) (70). Lysaten
die geïncubeerd werden met LPS gedurende verschillende periodes werden ook onderzocht op de
aanwezigheid van MMPs die gelatine klieven. Echter werden er in de lysaten geen MMPs
gedetecteerd d.m.v. zymografie. Het detectieniveau van de MMPs in de lysaten is mogelijks te
laag. Als controle werden moleculen met een MW > 9kDa gescheiden van de kleinere substanties
in het CM en werden beide fracties geanalyseerd d.m.v. gelatine zymografie. Alle MMPs hebben
een massa die groter is dan 9kDa, bijgevolg wordt er in de fractie < 9kDa geen gelatine klieving
gedetecteerd (Fig 5C).
3.1.2 SDS-PAGE en Western Blot
Gelatine zymografie geeft zekerheid over de aanwezigheid van MMPs (mogelijk MMP-2 en -9);
echter, zymografie is minder geschikt voor de kwantitatieve evaluatie van MMPs in de
verschillende samples. SDS-PAGE en Western Blotting laat een veel gevoeligere, specifiekere en
nauwkeurigere analyse toe omdat er met één bepaald antilichaam gewerkt wordt. De aanwezigheid
van MMPs werd nagegaan door gebruik te maken van respectievelijk MMP-2, MMP-9 en MMP-
7 C-terminale, polyclonale antilichamen (1/1000) geproduceerd in konijn (Sigma Aldrich). Het
secundaire antilichaam was anti-konijn (1/1000) gekoppeld aan alkalisch fosfatase. Als
ladingscontrole gebruikten we een antilichaam tegen beta-Tubuline (konijn, 1/5000, Abcam)
(cellysaat) of aankleuring van alle eiwitten op de membraan d.m.v. Sypro kleuring (Invitrogen)
(LPS-CM). Tubuline maakt deel uit van de microtubuli die permanent en abundant aanwezig zijn
in alle cellen. De expressie van MMPs wordt dan ook weergeven relatief ten opzichte van
tubuline/totaal eiwit, om kleine verschillen in lading en blotting efficiëntie te elimineren. In
cellysaten van RBE4 cellen die op verschillende tijdspunten blootgesteld werden aan LPS, lijken
pro-MMP-2, pro-MMP-9 en MMP-9 sterk te stijgen in functie van de tijd, maar MMP-2 lijkt te
dalen (Fig 6A-B, D). De moeilijke detectie van MMP-2 en MMP-9 in cellysaat leidde echter tot
een laag aantal bruikbare experimenten. Meer experimenten zijn nodig om hieruit definitieve
conclusies te kunnen trekken. De expressie van pro-MMP-7 en MMP-7 steeg duidelijk in functie
van de tijd dat de cellen werden blootgesteld aan LPS (Fig 6C,E). Ook CM > 9kDa van cellen
blootgesteld aan LPS werd onderzocht op de aanwezigheid en de expressie van MMP-2, -9 en -7
door middel van SDS-PAGE. Net zoals bij de lysaten is er een stijging van (pro)-MMP-9.
35
Fig 6. Expressie van MMP-2, MMP-9 en MMP-7 in RBE4 cellysaat na blootstelling aan LPS. A-C. Detectie van
(pro-)MMP-9 (A), (pro-)MMP-2 (B) en (pro-)MMP-7 (C) in RBE4 cellen blootgesteld aan LPS toont een sterke
stijging van zowel de pro- a,s de actieve vormen van deze MMPs. D-E. De grafieken tonen de gepoolde data van MMP
expressie voor (pro-)MMP-2 (n=1), (pro-)MMP-9 (n=1) en (pro-)MMP-7 (n=3) op de verschillende tijdspunten na
LPS (1 µg/mL) incubatie. (Pro-)MMP expressie in controle cellen werd gelijkgesteld aan 100% (stippellijn) en
expressie in LPS-behandelde cellen werd vergeleken met deze controle.
Fig 7. Expressie van MMP-2, MMP-9 en MMP-7 in CM > 9kDa van RBE4 cellen na blootstelling aan LPS.
Detectie van (pro-)MMP-2 en (pro-)MMP-9 en MMP-7 in CM > 9 kDa van RBE4 cellen die werden blootgesteld aan
LPS toont een matige stijging van (pro)-MMP-9 op de 3u en 24u tijdspunten en een geringe daling op 6h. (pro)-MMP-
2 lijkt te stijgen na 24h maar daalt eerst op de tijdspunten 3 en 6h (n=2). MMP7 volgt een gelijkaardig patroon als
MMP-2 (n=2).
36
In tegenstelling tot MMP-9 lijkt (pro)-MMP-2 te dalen in het CM. Verder is de aanwezigheid van
MMP-7 duidelijk te zien in LPS-CM(24h) maar niet op de andere tijdspunten. Anders dan in de
cellysaten observeerden we hier ook maar 1 bandje ter hoogte van MMP-7, maar pro-MMP7
(30kDa) kon niet worden gedetecteerd.
3.2 Effect van LPS en MMPs op Cx43 expressie in BHB endotheel RBE4 cellen blootgesteld
aan MMPs
Een van de hypothesen die gesteld worden in deze thesis is dat MMPs een effect hebben op de
expressie van Cx43 in het BHB endotheel. Om dit te testen werd de aanwezigheid van Cx43
nagegaan in lysaten van RBE4 cellen die werden blootgesteld aan LPS (1 µg/mL) of aan LPS-CM.
Confluente RBE4 culturen werden gedurende verschillende tijdspunten (3h, 6h en 24h)
geïncubeerd met LPS of 4h geïncubeerd met geconcentreerd LPS-CM (1/100) verdund in serum-
vrij medium. Foetaal kalfsserum bevat immers zelf MMPs die de resultaten kunnen beïnvloeden.
Cxs, waaronder ook Cx43, hebben een zeer kort halfleven (1-3h) (71) en 4h incubatie is bijgevolg
voldoende om een eventuele daling in Cx43 expressie door toedoen van MMPs op te pikken. De
expressie van Cx43 werd geëvalueerd d.m.v. SDS-PAGE en Western blotting (konijn anti-Cx43
C-terminus, Sigma Aldrich, 1/10,000) op de verschillende tijdspunten (3h, 6h en 24h) na toediening
van LPS of 4h na toediening van LPS-CM. De algemene trend, zowel in RBE4 cellen blootgesteld
aan LPS als in RBE4 cellen blootgesteld aan LPS-CM, was een chronologische daling van de Cx43
expressie over de verschillende tijdspunten (resp. n=5 en n=2) (Fig 8). Cx43 is een sterk
gefosforyleerd eiwit met het merendeel van de fosforylatie sites gelokaliseerd in het C-terminale
domein (72). Fosforylatie van Cx43 kan gedetecteerd worden op western blots door kleine
verschillen in migratiesnelheid in de polyacrylamide gel. Dit vertaalt zich in 3 laantjes: P0
vertegenwoordigt de niet-gefosforyleerde fractie Cx43; P1 en P2 vertegenwoordigen
respectievelijk de mid- en hoog-gefosforyleerde vormen van Cx43. Incubatie van RBE4 cellen met
LPS of LPS-CM lijkt geen effect te hebben op de fosforylatie status van Cx43 (Fig 8). Er werd ook
gekeken naar de expressie van Cx43 door gebruikt te maken van een antilichaam tegen de N-
terminus (konijn anti-Cx43 N-terminus, Sigma aldrich 1/5000). Dit werd uitgevoerd om te
controleren of het verminderde signaal met het C-terminale antilichaam het gevolg was van een
algemene daling in Cx43 expressie, dan wel een post-translationele modificatie of klieving van de
C-terminus door protease activiteit, zoals gesuggereerd in (16). De resultaten toonden een
gelijkaardige daling van de Cx43 expressie met het N-terminale antilichaam wanneer cellen
37
worden geïncubeerd met LPS, wat een indicatie is voor het feit dat de expressie van Cx43 globaal
daalt. Echter, wanneer cellen geïncubeerd worden met LPS-CM lijkt Cx43 expressie, geanalyseerd
met behulp van het N-terminale antilichaam, niet-significant gestegen. Dit suggereert een
modificatie van het C-terminale domein.
Fig 8. Expressie van Cx43 na blootstelling aan LPS en LPS-CM. A. De figuur toont de expressie van Cx43 over de
verschillende tijdspunten blootstelling aan LPS (n=5) of na 4h incubatie met LPS- CM van de verschillende tijspunten
(n=2). Beiden tonen een geringe daling. B. De expressie van Cx43 door middel van een N-terminaal antilichaam wordt
gevolgd over de verschillende tijdspunten dat lysaten werden blootgesteld aan LPS. De resultaten tonen een daling
t.o.v. de controle. In tegenstelling daarmee vertoont Cx43 een stijging in cellen behandeld met LPS-CM.
3.3 LPS-CM stimuleert gap junctionele koppeling en hemikanaal activiteit in RBE4 cellen.
3.3.1 Effect van LPS-CM op gap junctionele koppeling
GJC werd bestudeerd aan de hand van scrape loading and dye transfer (SLDT). In deze techniek
wordt gekeken naar de spreiding van de fluorescente en GJ-permeabele kleurstof, 6-
carboxyfluoresceine (6-CF, 376.3 Da ), vanuit de scrape-loaded cellen naar de daarmee
gekoppelde cellen. Deze spreiding volgt een exponentieel verloop waaruit de spatiale constante
(1/K), een maat voor de spreiding, afgeleid wordt. Deze is representatief voor de mate van GJC.
Confluente RBE4 culturen werden gedurende 4h geïncubeerd met geconcentreerd LPS-CM
gecollecteerd van RBE4 cellen die gedurende 3h, 6h of 24h werden blootgesteld aan LPS (1
38
µg/mL) (1/100 in serum-vrij medium). Incubatie van RBE4 culturen met dit CM, versterkt GJC.
Het geconcentreerde LPS-CM bevat alle componenten die groter zijn dan 9kDa, inclusief LPS zelf
(10-20 kDa) en pro-inflammatoire moleculen zoals TNF (17 kDa) en IL1 (17 ka) die
geproduceerd worden in respons op LPS en welke allen zelf een effect hebben op Cx expressie en
GJC (35). Om eventuele effecten van LPS-CM op de functionaliteit van GJs toe te schrijven aan
de daarin aanwezige MMPs maakten we daarom gebruik van 10 µM batimastat, een breed
spectrum inhibitor van MMPs. Analyse van SLDT toont een duidelijke stijging van de GJC in
cellen behandeld met LPS-CM(6h) en LPS-CM(24h) (n=4). Deze stijging wordt volledig teniet
gedaan in aanwezigheid van batimastat, wat aantoont dat MMPs verantwoordelijk zijn voor de
stijging in GJC (Fig 9A). Opmerkelijk is de vaststelling dat deze verhoogde functionaliteit van GJs
gepaard gaat met een licht gedaalde Cx43 expressie (zie 3.2).
3.3.2 Effect van LPS-CM op hemikanaal activiteit
Subconfluente RBE4 culturen waarin cellen niet aan elkaar grenzen en waarin dus geen GJs
gevormd kunnen worden werden gebruikt voor de evaluatie van HK activiteit. Cellen werden
behandeld met LPS-CM zoals beschreven in 3.3.1. HK opening werd bestudeerd d.m.v. dye uptake.
Propidium iodide (PI; 2mM), een fluorescente kleurstof met moleculaire massa van 668 Da wordt
toegevoegd in aanwezigheid van LPS-CM (10 min) om de opening van HKn waar te nemen. Het
is zo dat de HKn meestal dicht zijn onder normale fysiologische omstandigheden en dat ze openen
onder impuls van inflammatoire triggers (9, 12, 33). Om het aantal PI-positieve cellen uit te
drukken als fractie van het totale aantal cellen worden alle cellen aangekleurd met de membraan
permeabele kleurstof Hoechst, die net zoals PI intercaleert in het DNA en de celkern aankleurt.
Vier uur incubatie met LPS-CM (1/100) in serum-vrij medium (zie 3.3.1) leidt tot een stijging
van de HK opening t.o.v. controle-CM met een significante stijging bij LPS-CM(6h) en LPS-
CM(24h) (n=2). Dit effect werd teniet gedaan wanneer batimastat (10 µM) werd gepreïncubeerd
wat een rol aantoont voor MMPs in het CM (Fig 9B). Dye uptake wordt eveneens geïnhibeerd door
Carbenoxole (Cbx, 25µM), een breed spectrum Cx kanaal blokker. Dit toont aan dat de PI werd
opgenomen door open HKn en niet door disruptie van de celmembraan wat optreedt bij celdood
(Fig 9C).
39
Fig 9. Effect van LPS-CM en MMPs op gap
junctionele koppeling en hemikanaal opening in
RBE4 endotheel. A. GJC, geëvalueerd volgens SLDT,
wordt significant versterkt na incubatie met LPS-
CM(6h) en LPS-CM(24h). Deze potentiatie wordt teniet
gedaan wanneer de breed spectrum MMP inhibitor
batimastat (10µM) wordt gepreïncubeerd, wat een rol
voor MMPs in het LPS-CM aantoont. N=4
onafhankelijke experimenten, * significant verschillend
van controle, ^ significant verschillend van het
corresponderende tijdspunt zonder batimastat. B.
Incubatie van RBE4 cellen aan LPS-CM leidt tot een verhoogd aantal PI-positieve cellen. Batimastat reduceert deze
potentiatie weer. n=2 onafhankelijke experimenten, * significant verschillend van kleurstofopname in cellen behandeld
met Ctrl-CM en ^ significant verschillend van het corresponderende CM zonder batimastat. C. Carbenoxolone (25µM,
30min preïncubatie) verhindert eveneens de stijging in PI-positieve cellen teweeggebracht door LPS-CM.
3.4 LPS-CM stimuleert Ca2+ dynamiek in RBE4 cellen
Cx kanalen zijn in belangrijke mate betrokken bij intra- en intercellulaire Ca2+ signalisatie, zo
ondersteunen GJs de directe communicatie van Ca2+ golven, dragen HKn bij tot de paracriene
propagatie van Ca2+ golven en dragen deze laatste ook bij tot intracellulaire Ca2+ oscillaties.
Aangezien de Ca2+ dynamiek ook een belangrijke determinant is voor BHB functie zal nu gekeken
worden wat het effect is van de gevonden MMPs op de Ca2+ dynamiek van deze cellen. Voor dit
experiment werden EC geïncubeerd met CM > 9kDa (1/100 in serum-vrij medium) die
verschillende periodes werd blootgesteld aan LPS. Vervolgens werd de Ca2+-dynamiek bestudeerd
door de cellen te laden met fluo-4 (10µM) en te visualiseren onder de fluorescentiemicroscoop. De
Ca2+ golven werden getriggerd door het verlagen van de extracellulaire Ca2+ concentratie. Dit is
een gekende trigger van HK opening in RBE4 cellen en stimuleert Ca2+ golven, waarschijnlijk door
de loslating van ATP langs open HKn dat vervolgens G-eiwit gekoppelde receptoren op naburige
cellen activeert (6).
40
Fig 10. Effect van LPS-CM op Ca2+ dynamiek in RBE4 cellen. Incubatie van confluente RBE4 culturen met LPS-
CM leidt tot een verhoogd aantal Ca2+ golven en een verhoogd aantal oscillerende cellen in Ca2+-vrij medium. n=3, *
significant t.o.v. Ctrl-CM.
De resultaten tonen een stijging van het aantal oscillerende cellen met LPS-CM ten opzichte van
cellen blootgesteld aan Ctrl-CM. Ook het aantal Ca2+ golven dat optreedt in de 10min durende
observatieperiode neemt toe in aanwezigheid van LPS-CM (Fig 10). Op basis van de beelden kan
ook geconcludeerd worden dat het merendeel van de Ca2+ golven paracrien is, wat duidt op een rol
voor HKn (data niet getoond). Deze data, samen met de dye uptake en SLDT data geven aanleiding
tot het besluit dat MMPs HK opening en GJC versterken wat leidt tot verhoogde Ca2+ golf activiteit.
Het gebruik van batimastat is echter noodzakelijk om de rol van MMPs hierin definitief te
bevestigen.
3.5 Effect van LPS-CM op expressie en lokalisatie van Cx43, Cx37 en Cx40
Het effect van LPS-CM op Cx43 expressie werd reeds nagegaan d.m.v. SDS-PAGE en Western
blotting, maar deze techniek zegt niets over de eventuele redistributie van Cxs in de cel. Daarom
keken we ook naar Cx43 expressie met behulp van immunokleuring. Daarenboven gebruikten we
deze techniek ook om de expressie van de andere endotheliale Cxs, Cx37 en Cx40, na te gaan. De
expressie van Cx43 leek te dalen net zoals het geval was bij Western Blotting. De immuunkleuring
met het C-terminale antilichaam bevestigt dus de resultaten van de WB (Fig 11). Ondanks de
dalende expressie konden in elk van de condities wel nog GJ plaques waargenomen worden. Samen
met expressie van Cx43 blijkt ook de expressie van Cx37 te dalen (Fig 11). Daarentegen stijgt de
expressie van Cx40 sterk in aanwezigheid van LPS-CM(3h) en LPS-CM(6h) (Fig 11). Cx40 kan
dus eventueel verantwoordelijk zijn voor de verhoogde GJC en toegenomen HK opening die wordt
waargenomen met dalende Cx37 en Cx43 expressie in aanwezigheid van LPS-CM.
41
Fig 11. Effect van LPS-CM op Cx expressie. Representatieve beeldjes van een immunokleuring tegen Cx43, Cx40
en Cx37 toont dat blootstelling aan LPS-CM leidt tot een progressieve daling van Cx43 en Cx37, en een stijging van
Cx40 welke zich lijken te herstellen bij LPS-CM(24h). De pijltjes wijzen op de aanwezigheid van gap junctionele
plaques. Scale bar is 25µm.
3.6 Batimastat stimuleert gap junctionele koppeling en hemikanaal opening na directe
blootstelling aan LPS
We evalueerden eveneens het effect van directe exposie aan LPS (1 µg/mL) op GJC en HK
opening. De rol van MMPs werd daarbij opnieuw onderzocht door middel van batimastat.
Opmerkelijk genoeg zijn de resultaten hierbij volledig tegengesteld aan de resultaten die we
behaalden met LPS-CM. Een lichte, doch niet significante stijging van de GJC werd gezien t.o.v.
de controle (n=3) maar deze stijging is veel geringer dan wanneer er gewerkt wordt met LPS-CM.
Nog frappanter is dat wanneer de inhibitor batimastat toegevoegd wordt een toename in GJC
optreedt. Gelijkaardige resultaten werden behaald voor dye uptake studies. Dit suggereert dat
MMPs in deze experimentele opzet een eerder inhiberende rol spelen, tegengesteld aan wat
geobserveerd wordt in cellen die werden blootgesteld aan geconcentreerd LPS-CM waarin enkel
componenten > 9kDa aanwezig zijn. Verdere studies naar de expressie en lokalisatie van Cx37,
Cx40 en Cx43 zullen hierover meer uitsluitsel kunnen geven.
42
Fig 12. Effect van LPS op gap junctionele koppeling en
hemikanaal opening in RBE4 endotheel. A. GJC,
geëvalueerd volgens SLDT, wordt mild, doch niet
significant, versterkt na incubatie met LPS (1µg/mL) op 6h
en 24h na blootsteling. Incubatie met de breed spectrum
MMP inhibitor batimastat (10µM) potentieert dye
koppeling wat een inhiberende rol voor MMPs aantoont,
tegengesteld aan hun rol in LPS-CM . N=3 onafhankelijke
experimenten B-C. Exposie van RBE4 cellen aan LPS leidt
tot een verhoogd aantal PI-positieve cellen. Ook hier
stimuleert batimastat dye uptake verder (n=3
onafhankelijke experimenten); * significant verschillend van kleurstofopname in cellen behandeld met vehicle en ^
significant verschillend van het corresponderende tijdspunt zonder batimastat. Carbenoxolone (25µM, 30min
preïncubatie) verhindert de stijging in PI-positieve cellen teweeggebracht door LPS, behalve op 24h na LPS
behandeling, wat zou kunnen ijzen op een lichte mate van celdood.
43
4. DISCUSSIE
4.1 Doel van de studie
Zoals beschreven in de inleiding, hebben Cxs een invloed op de permeabiliteit van de BHB en
speelt Ca2+ hierin een belangrijk rol speelt (6, 13). Het doel van deze studie was om na te gaan of
MMPs, via een invloed op Cxs, BHB permeabiliteit kunnen beïnvloeden in inflammatoire
omstandigheden. Het idee voor deze studie kwam voort van resultaten uit het hart, waar men voor
het eerst kon aantonen dat Cx43 een substraat is van MMPs. Zo zou het gating particle (de C-
terminus) van Cx43 een substraat zijn van MMP-7. Verder speelt MMP-7 een belangrijke rol in de
GJC koppeling in het hart aangezien MMP-7 knockout leidt tot een verhoogde elektrische
conductie na een myocard infarct (16). Van een familie van 25 MMPs zijn de gelatinasen MMP-2
en MMP-9 het sterkst aanwezig in de vroege en late stadia van chronisch hartfalen (65). Tijdens
perifere en centrale inflammatie worden deze zelfde MMPs ook vrijgesteld in het hersenweefsel
en het bloed (51, 56, 57) en zijn het ook de gelatinasen die het meest bijdragen tot BHB disruptie
(53). In deze thesis onderzoeken we of Cx43, dat tot expressie komt in het BHB endotheel, een
substraat is van MMP-2, MMP-9 en MMP-7 en of de interactie tussen deze MMPs en Cx43
aanleiding geeft tot verhoogde endotheliale [Ca2+]i, wat een mediator is van BHB dysfunctie.
4.2 LPS activeert en verhoogt MMP expressie
De resultaten tonen een verhoogde expressie en activatie van MMPs in inflammatoire
omstandigheden. Dit komt overeen met talrijke studies over neurologische aandoeningen waar er
in combinatie van neuroinflammatie een verhoogde expressie en activiteit is van MMPs (73, 74).
Inflammatie werd in vitro nagebootst door de toediening van LPS, een component van gram-
negatieve bacteriën waarvan geweten is dat het MMPs activeert (75), aan RBE4 cellen. Van deze
cellen werden de lysaten en het CM gecontroleerd op de aanwezigheid van MMPs. De initiële
detectie gebeurde door gebruik te maken van gelatine zymografie. Hier zagen we duidelijk de
aanwezigheid van de gelatinases in het CM, welke op basis van hun MW, als MMP-2 of MMP-9
geïdentificeerd konden worden. MMP-7 kon via de zymografie niet gedetecteerd worden. Hoewel
dit protease geacht wordt gelatine te klieven (69), blijkt een caseine gel meer optimaal te zijn voor
de detectie ervan (70). Net door deze moeilijke detectiemogelijkheid in gelatinegels en zelfs in
caseinegels werd een heparin-enhanced zymography ontwikkeld voor de detectie van MMP-7 (76)
en deze techniek kan in de toekomst ook in deze studie gebruikt worden. In lysaten van RBE4
44
cellen blootgesteld aan LPS werden geen MMPs gedetecteerd d.m.v. gelatine zymografie.
Mogelijks is het detectieniveau van de MMPs te laag in de lysaten. De expressie van de
verschillende MMPs werd eveneens nagegaan door gebruik te maken van gel electroforese en
Western blotting. Hiermee zagen we in de lysaten wel een duidelijke stijging van alle (pro)-MMPs
in functie van de periode van blootstelling aan LPS. Deze detectie zal echter nog een aantal maal
herhaald moeten worden om een statistisch significante conclusie te geven. Ook m.b.v. Western
blotting bleef het echter erg moeilijk om MMPs te detecteren, de reden waarom is helaas nog
onduidelijk. Net als in de zymogram, toont het CM een matige stijging van (pro)-MMP-9 op de 3h
en 24h tijdspunten (en een geringe daling op 6h). (Pro)-MMP-2 en MMP-7 lijken te stijgen na 24u
maar dalen eerst op 3h en 6h. Zoals hierboven vermeld is MMP-9 het dominante gelatinase wat
betreft de BHB schade (40). De reden dat (pro)-MMP-2 daalt na 3 en 6h en dan weer stijgt na 24h
kan zijn doordat het prominenter aanwezig is in ruststadia en nadien ook in de fase van
weefselherstel. MMP-2 draagt bij aan de initiële schade, maar het verder verloop wordt vooral
gemedieerd door MMP-9. MMPs hebben een duale rol omdat ze kunnen bijdragen tot
neurovasculaire schade en herstel. Zo is MMP-2 expressie vooral gestegen de eerste 2-5 dagen na
een beroerte en ziet men op subcellular niveau in herseninfarct regio’s dat vooral MMP-9 en TIMP-
2 opgereguleerd zijn in cerebrale bloedvaten (44). De expressie van TIMPs moet in toekomst nog
in rekening worden gebracht en er moet verder gezocht worden naar een verklaring voor het
verschil in expressiepatronen van intra- en extracellulaire MMPs.
4.3 Effect van LPS en MMPs op Cx43 expressie in BHB endotheel RBE4 cellen blootgesteld
aan MMPs
Ons baserend op het onderzoek in het hart, weten we dat Cx43 een substraat vormt van MMPs
(16). Daarom wilden we deze hypothese eveneens testen in BHB endotheel. Uit bovenstaande
experimenten hebben we zekerheid over de aanwezigheid van MMPs in cellen blootgesteld aan
LPS (lysaten) en LPS-CM. De invloed van MMPs op de expressie van Cx43 in RBE4 cellen werd
vervolgens getest door cellen bloot te stellen aan LPS of LPS-CM. De algemene trend, zowel in
RBE4 cellen blootgesteld aan LPS als aan LPS-CM is een chronologische daling van de Cx43
detectie over de verschillende tijdspunten. Dit bevestigt dat de MMPs aanwezig tijdens inflammatie
de expressie van Cx43 kunnen down-reguleren. Opmerkelijk echter, is dat bij de cellen blootgesteld
aan LPS het volledige eiwit (gedetecteerd met een N- en C-terminaal antilichaam) een lagere
expressie vertoont terwijl in LPS-CM enkel de detectie met het C-terminale antilichaam een daling
45
vertoont, terwijl N-terminale detectie een stijging vertoont. Dit wijst mogelijk op een post-
translationele modificatie of afbraak het het Cx43 C-terminale domein door de proteasen waardoor
het C-terminale antilichaam zijn target niet meer herkent. Toekomstige experimenten met de MMP
inhibitor batimastat zullen moeten uitwijzen of de down-regulatie/modificatie volledig en enkel te
wijten is aan MMPs, dan wel aan andere componenten aanwezig tijdens inflammatie. Het feit dat
in CM geen componenten zitten kleiner dan 9kDa kan alleszins de verschillende expressiepatronen
tussen LPS en LPS-CM verklaren. Tevens kunnen we ook niet weten of de verlaagde expressie
met zekerheid te wijten is aan de gedetecteerde MMPs, met name MMP-2, MMP-9 en MMP-7. Ze
zijn zeker en vast de prominente MMPs aanwezig tijdens herseninflammatie (53), maar er zijn ook
andere MMPs (oa. MMP-3 en MMP-13) actief aanwezig (44). Ook werd via een oppervlakte
resonantie techniek aangetoond dat in het hart, Cx43 mogelijk geen substraat is van MMP-2 (16).
Een toekomstperspectief is om alle betrokken MMPs te identificeren en cellen rechtstreeks te
incuberen met deze MMPs om hun individuele rol op Cx43 expressie te achterhalen.
4.4 LPS-CM stimuleert gap junctionele koppeling en hemikanaal activiteit in RBE4 cellen.
BHB opening, gemedieerd door MMPs in neuroinflammatie (53), gebeurt vnl. via afbraak van de
ECM en TJs, maar Cxs spelen ook een rol in de BHB opening door stabilisatie van de juncties en
ook door hun bijdrage aan [Ca2+]i. De intrinsieke gating eigenschappen van Cxs, die veelal omvat
zijn in het C-terminale domein en gevoelig zijn aan [Ca2+]i (77) zelf, pH (77) en fosforylatie-status
(72) zijn hierbij essentieel. Of MMPs direct een invloed uitoefenen op de gating, en dus op Cx
kanaal functie, is nog niet geweten. Daarom werden functionele testen uitgevoerd die aangeven of
GJC en HK opening wijzigen in aanwezigheid van MMPs. De stijging van GJC en HK activiteit
in cellen behandeld met LPS-CM(6h) en LPS-CM(24h) werd volledig teniet gedaan door de
aanwezigheid van batimastat wat aantoont dat MMPs verantwoordelijk zijn voor de stijging in GJC
en HK activiteit. GJC en HK opening wordt beïnvloed op twee verschillende manieren; enerzijds
is er de lange termijn regulatie, zijnde het aantal Cxs of GJ plaques aanwezig in de membraan, en
anderzijds is er de korte termijn regulatie zijnde de gating eigenschappen van het kanaal (78). In
LPS-CM speelt duidelijk de korte termijn regulatie een rol. Aangezien detectie met het N-terminale
antilichaam erop wijst dat niet het volledige eiwit wordt gedownreguleerd moet er sprake zijn van
protease activiteit die de C-terminus klieft of van post-translationele modificaties in dit domein die
een invloed hebben op de gating en waardoor detectie met het C-terminale antilichaam niet meer
mogelijk is. Fosforylatie is een voorbeeld van een post-translationele modificatie. Fosforylatie is
46
niet nodig voor de vorming van GJs aangezien Cx26, het Cx met de kortste C-terminus zonder
fosforylatiesites toch nog functionele GJs kan vormen (72). De fosforylatie-status bepaalt wel in
belangrijke mate de sterkte van GJC. Het C-terminale antilichaam is gericht tegen een deel van de
C-terminus, zijnde de laatste 19 aminozuren, waar zich residuen bevinden die gefosforyleerd
worden door verscheidene kinasen en aanleiding geven tot een gewijzigde GJC (72). Fosforylatie
is ook betrokken bij het ball-and-chain mechanisme, een interactie tussen de intracellulaire lus (IL)
en de CT van Cxs die normaliter GJs sluit (79). Fosforylatie zorgt voor de insertie van negatieve
ladingen in de CT waardoor die kan interageren met de positieve ladingen van de IL. Wanneer de
IL reageert met de CT zijn de GJs dicht. Echter, fosforylatie van serine residuen door bv. PKA die
GJC verhogen of een verandering van IL-CT interactie door gewijzigde fosforylatie is mogelijk
niet betrokken bij MMPs aangezien we geen veranderingen zagen in de fosforylatiestatus van Cx43
(zie Fig 8A). Een andere verklaring voor de verhoogde functionaliteit en gedaalde Cx43 C-
terminale detectie is de verhoogde protease activiteit, bv. MMPs die het C-terminale domein
verwijderen, zoals aangetoond in het hart (16), hierdoor zal IL-CT interactie niet kunnen doorgaan
en blijven GJs open. Finaal tonen immuunkleuringen samen met een daling van Cx43 (C-terminale
detectie) ook een daling van Cx37. Deze gecoördineerde regulatie werd reeds eerder beschreven
(6). Belangrijker nog is dat Cx40 expressie stijgt wat een andere, mogelijke verklaring is voor de
gestegen GJC. Verder onderzoek zal dit, alsook de invloed van MMPs op de andere endotheliale
Cxs, verder moeten aantonen.
4.5 LPS-CM stimuleert Ca2+ dynamiek in RBE4 cellen
In BHB endotheel veroorzaken lage extracellulaire [Ca2+] condities intercellulaire Ca2+-golven die
de BHB permeabiliteit verhogen. Deze Ca2+ golven zijn gebaseerd zijn op de beweging van IP3
en/of Ca2+ via GJs of op paracriene signalisatie waarbij HKn functioneren als een ATP
vrijstellingskanaal (13). Via hun bijdrage aan de endotheliale Ca2+-dynamiek dragen Cxs zo bij tot
de alteratie van de BHB permeabiliteit. Daarom is het verlagen van extracellaire [Ca2+] een ideale
manier om de invloed van de MMPs (aanwezig in het CM) op Cxs en daarmee geassocieerde
verandering in BHB permeabiliteit te bestuderen. Het resultaat toont een stijgend aantal repetitieve
Ca2+ oscillaties en een stijgend aantal, veelal paracriene, Ca2+ golven in aanwezigheid van LPS-
CM. Dit toont aan dat de MMPs een invloed kunnen hebben op de Ca2+ dynamiek (batimastat moet
echter in de toekomst bevestiging brengen) en bijgevolg op de BHB permeabiliteit. Dit experiment
47
suggereert dat de hypothese van deze thesis, dat de MMPs de BHB permeabiliteit kunnen verhogen
op een Cx- en Ca2+ gemedieerde manier, bevestigd kan worden.
4.6 Batimastat stimuleert gap junctionele koppeling en hemikanaal opening na directe
blootstelling aan LPS
SLDT en Dye Uptake werden herhaald in RBE4 cellen die rechtstreeks geïncubeerd werden met
LPS. Tegengesteld aan wat verwacht werd, ziet men net een stijging in GJC en HK opening in
aanwezigheid van batimastat. Dit doet vermoeden dat er andere mechanismen betrokken zijn. LPS
leidt inderdaad tot een volledige downregulatie van Cx43 want ook detectie met het N-terminale
antilichaam toont een daling. Toekomstig onderzoek van de expressie van andere Cxs zal mogelijks
een verklaring geven waarom de GJC toch lichtjes stijgt. Andere Cxs kunnen immers de negatieve
regulatie van Cx43 opvangen. Een mogelijke verklaring voor de verschillen tussen LPS en LPS-
CM is dat de LPS en MMP concentraties hoger zijn in het geconcentreerde CM. Andere
componenten die in de <9kDa fractie zitten worden tevens uitgesloten bij exposie aan LPS-CM,
maar zijn nog aanwezig bij LPS incubatie. Intracellulaire werking van MMPs kan verschillen van
extracellulaire werking of er kunnen andere MMPs in de cel aanwezig zijn in vergelijking met
extracellulaire MMPs. Het is inderdaad zo dat batimastat een breed spectrum inhibitor is die
activatie van MMP-1, MMP-3, MMP-2, MMP-9 en MMP-7 verhindert. Maar de aanwezigheid van
MMP-1 en MMP-3 werd niet nagegaan in de cellysaten en het LPS-CM. De aan of afwezigheid
van deze MMPs kan dus ook een invloed hebben op de GJC.
REFERENTIES
1. De Bock M, Vandenbroucke RE, Decrock E, Culot M, Cecchelli R, Leybaert L. A new angle on blood-CNS
interfaces: A role for connexins? Febs Lett. 2014;588(8):1259-70.
2. Abbott NJ, Patabendige AAK, Dolman DEM, Yusof SR, Begley DJ. Structure and function of the blood-brain
barrier. Neurobiol Dis. 2010;37(1):13-25.
3. Abbott NJ, Friedman A. Overview and introduction: The blood-brain barrier in health and disease. Epilepsia.
2012;53:1-6.
4. Seo JH, Guo SZ, Lok J, Navaratna D, Whalen MJ, Kim KW, et al. Neurovascular Matrix Metalloproteinases and
the Blood-Brain Barrier. Curr Pharm Design. 2012;18(25):3645-8.
5. Hawkins BT, Davis TP. The blood-brain barrier/neurovascular unit in health and disease. Pharmacol Rev.
2005;57(2):173-85.
6. De Bock M, Culot M, Wang N, Bol M, Decrock E, De Vuyst E, et al. Connexin channels provide a target to
manipulate brain endothelial calcium dynamics and blood-brain barrier permeability. J Cerebr Blood F Met.
2011;31(9):1942-57.
7. Danesh-Meyer HV, Green CR. Focus on Molecules: Connexin 43-Mind the gap. Exp Eye Res. 2008;87(6):494-5.
48
8. Davidson JO, Green CR, Nicholson LFB, Bennet L, Gunn AJ. Connexin hemichannel blockade is neuroprotective
after, but not during, global cerebral ischemia in near-term fetal sheep. Exp Neurol. 2013;248:301-8.
9. Robertson J, Lang S, Lambert PA, Martin PE. Peptidoglycan derived from Staphylococcus epidermidis induces
Connexin43 hemichannel activity with consequences on the innate immune response in endothelial cells. Biochem J.
2010;432:133-43.
10. Yoon JJ, Green CR, O'Carroll SJ, Nicholson LFB. Dose-dependent protective effect of connexin43 mimetic peptide
against neurodegeneration in an ex vivo model of epileptiform lesion. Epilepsy Res. 2010;92(2-3):153-62.
11. Decrock E, De Vuyst E, Vinken M, Van Moorhem M, Vranckx K, Wang N, et al. Connexin 43 hemichannels
contribute to the propagation of apoptotic cell death in a rat C6 glioma cell model. Cell Death Differ. 2009;16(1):151-
63.
12. Orellana JA, Saez PJ, Shoji KF, Schalper KA, Palacios-Prado N, Velarde V, et al. Modulation of Brain
Hemichannels and Gap Junction Channels by Pro-Inflammatory Agents and Their Possible Role in Neurodegeneration.
Antioxid Redox Sign. 2009;11(2):369-99.
13. De Bock M, Wang N, Decrock E, Bol M, Gadicherla AK, Culot M, et al. Endothelial calcium dynamics, connexin
channels and blood-brain barrier function. Prog Neurobiol. 2013;108:1-20.
14. Haorah J, Ramirez SH, Schall K, Smith D, Pandya R, Persidsky Y. Oxidative stress activates protein tyrosine
kinase and matrix metalloproteinases leading to blood-brain barrier dysfunction. J Neurochem. 2007;101(2):566-76.
15. Jin R, Yang GJ, Li GH. Molecular insights and therapeutic targets for blood-brain barrier disruption in ischemic
stroke: Critical role of matrix metalloproteinases and tissue-type plasminogen activator. Neurobiol Dis.
2010;38(3):376-85.
16. Lindsey ML, Escobar P, Mukherjee R, Goshorn DK, Sheats NJ, Bruce JA, et al. Matrix metalloproteinase-7 affects
connexin-43 levels, electrical conduction, and survival after myocardial infarction. Circulation. 2006;113(25):2919-
28.
17. Wu XH, Huang W, Luo G, Alain LA. Hypoxia induces connexin 43 dysregulation by modulating matrix
metalloproteinases via MAPK signaling. Mol Cell Biochem. 2013;384(1-2):155-62.
18. Wang J, Li JS, Liu HZ, Yi SL, Su GY, Zhang Y, et al. Dynamic alterations of connexin43, matrix
metalloproteinase-2 and tissue inhibitor of matrix metalloproteinase-2 during ventricular fibrillation in canine. Mol
Cell Biochem. 2014;391(1-2):259-66.
19. De Bock M, Decrock E, Wang N, Bol M, Vinken M, Bultynck G, et al. The dual face of connexin-based astroglial
Ca2+ communication: A key player in brain physiology and a prime target in pathology. Bba-Mol Cell Res.
2014;1843(10):2211-32.
20. Abbott NJ, Ronnback L, Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier. Nat Rev Neurosci.
2006;7(1):41-53.
21. Wolburg H, Noell S, Mack A, Wolburg-Buchholz K, Fallier-Becker P. Brain endothelial cells and the glio-vascular
complex. Cell Tissue Res. 2009;335(1):75-96.
22. Bauer HC, Bauer H. Neural induction of the blood-brain barrier: Still an enigma. Cell Mol Neurobiol.
2000;20(1):13-28.
23. Somjen GG. The regulation of ions in the brain. Oxford University Press. 2004:13-62.
24. Collard CD, Park KA, Montalto MC, Alapati S, Buras JA, Stahl GL, et al. Neutrophil-derived glutamate regulates
vascular endothelial barrier function. J Biol Chem. 2002;277(17):14801-11.
25. Kim YV, Di Cello F, Hillaire CS, Kim KS. Differential Ca2+ signaling by thrombin and protease-activated
receptor-1-activating peptide in human brain microvascular endothelial cells. Am J Physiol-Cell Ph. 2004;286(1):C31-
C42.
26. Raslan F, Schwarz T, Meuth SG, Austinat M, Bader M, Renne T, et al. Inhibition of bradykinin receptor B1 protects
mice from focal brain injury by reducing blood-brain barrier leakage and inflammation. J Cerebr Blood F Met.
2010;30(8):1477-86.
27. Berridge MJ, Lipp P, Bootman MD. The versatility and universality of calcium signalling. Nat Rev Mol Cell Bio.
2000;1(1):11-21.
28. Kuhlmann CRW, Gerigk M, Bender B, Closhen D, Lessmann V, Luhmann HJ. Fluvastatin prevents glutamate-
induced blood-brain-barrier disruption in vitro. Life Sci. 2008;82(25-26):1281-7.
29. Verin AD, Cooke C, Herenyiova M, Patterson CE, Garcia JGN. Role of Ca2+/calmodulin-dependent phosphatase
2B in thrombin-induced endothelial cell contractile responses. Am J Physiol-Lung C. 1998;275(4):L788-L99.
30. Fischer S, Wiesnet M, Renz D, Schaper W. H2O2 induces paracellular permeability of porcine brain-derived
microvascular endothelial cells by activation of the p44/42 MAP kinase pathway. Eur J Cell Biol. 2005;84(7):687-97.
31. Wilhelm I, Farkas AE, Nagyoszi P, Varo G, Balint Z, Vegh GA, et al. Regulation of cerebral endothelial cell
morphology by extracellular calcium. Phys Med Biol. 2007;52(20):6261-74.
49
32. De Bock M, Culot M, Wang N, da Costa A, Decrock E, Bol M, et al. Low extracellular Ca2+ conditions induce an
increase in brain endothelial permeability that involves intercellular Ca2+ waves. Brain Res. 2012;1487:78-87.
33. Chandrasekhar A, Bera AK. Hemichannels: permeants and their effect on development, physiology and death. Cell
Biochem Funct. 2012;30(2):89-100.
34. De Bock M, Kerrebrouck M, Wang N, Leybaert L. Neurological manifestations of oculodentodigital dysplasia: a
Cx43 channelopathy of the central nervous system? Frontiers in pharmacology. 2013;4:120.
35. Eugenin EA, Basilio D, Saez JC, Orellana JA, Raine CS, Bukauskas F, et al. The Role of Gap Junction Channels
During Physiologic and Pathologic Conditions of the Human Central Nervous System. J Neuroimmune Pharm.
2012;7(3):499-518.
36. Liao Y, Day KH, Damon DN, Duling BR. Endothelial cell-specific knockout of connexin 43 causes hypotension
and bradycardia in mice. P Natl Acad Sci USA. 2001;98(17):9989-94.
37. Decrock E, Krysko DV, Vinken M, Kaczmarek A, Crispino G, Bol M, et al. Transfer of IP3 through gap junctions
is critical, but not sufficient, for the spread of apoptosis. Cell Death Differ. 2012;19(6):947-57.
38. Kawano S, Otsu K, Kuruma A, Shoji S, Yanagida E, Muto Y, et al. ATP autocrine/paracrine signaling induces
calcium oscillations and NFAT activation in human mesenchymal stem cells. Cell Calcium. 2006;39(4):313-24.
39. Verma V, Hallett MB, Leybaert L, Martin PE, Evans WH. Perturbing plasma membrane hemichannels attenuates
calcium signalling in cardiac cells and HeLa cells expressing connexins. Eur J Cell Biol. 2009;88(2):79-90.
40. Dejonckheere E, Vandenbroucke RE, Libert C. Matrix metalloproteinases as drug targets in ischemia/reperfusion
injury. Drug Discov Today. 2011;16(17-18):762-78.
41. Zlokovic BV. The blood-brain barrier in health and chronic neurodegenerative disorders. Neuron. 2008;57(2):178-
201.
42. Zattoni M, Mura ML, Deprez F, Schwendener RA, Engelhardt B, Frei K, et al. Brain Infiltration of Leukocytes
Contributes to the Pathophysiology of Temporal Lobe Epilepsy. J Neurosci. 2011;31(11):4037-50.
43. Kundu S, Pushpakumar SB, Tyagi A, Coley D, Sen U. Hydrogen sulfide deficiency and diabetic renal remodeling:
role of matrix metalloproteinase-9. Am J Physiol-Endoc M. 2013;304(12):E1365-E78.
44. Morancho A, Rosell A, Garcia-Bonilla L, Montaner J. Metalloproteinase and stroke infarct size: role for anti-
inflammatory treatment? Ann Ny Acad Sci. 2010;1207:123-33.
45. Eugenin EA, Eckardt D, Theis M, Willecke K, Bennett MVL, Saez JC. Microglia at brain stab wounds express
connexin 43 and in vitro form functional gap junctions after treatment with interferon-gamma and tumor necrosis
factor-alpha. P Natl Acad Sci USA. 2001;98(7):4190-5.
46. Sarieddine MZR, Scheckenbach KEL, Foglia B, Maass K, Garcia I, Kwak BR, et al. Connexin43 modulates
neutrophil recruitment to the lung. J Cell Mol Med. 2009;13(11-12):4560-70.
47. Butler GS, Overall CM. Updated Biological Roles for Matrix Metalloproteinases and New "Intracellular"
Substrates Revealed by Degradomics. Biochemistry-Us. 2009;48(46):10830-45.
48. Chow AK, Cena J, Schulz R. Acute actions and novel targets of matrix metalloproteinases in the heart and
vasculature. Brit J Pharmacol. 2007;152(2):189-205.
49. Hulboy DL, Rudolph LA, Matrisian LM. Matrix metalloproteinases as mediators of reproductive function. Mol
Hum Reprod. 1997;3(1):27-45.
50. Vu TH, Werb Z. Matrix metalloproteinases: effectors of development and normal physiology. Gene Dev.
2000;14(17):2123-33.
51. Roy R, Zhang B, Moses MA. Making the cut: Protease-mediated regulation of angiogenesis. Exp Cell Res.
2006;312(5):608-22.
52. Page-McCaw A, Ewald AJ, Werb Z. Matrix metalloproteinases and the regulation of tissue remodelling. Nat Rev
Mol Cell Bio. 2007;8(3):221-33.
53. Gurney KJ, Estrada EY, Rosenberg GA. Blood-brain barrier disruption by stromelysin-1 facilitates neutrophil
infiltration in neuroinflammation. Neurobiol Dis. 2006;23(1):87-96.
54. Kupai K, Szucs G, Cseh S, Hajdu I, Csonka C, Csont T, et al. Matrix metalloproteinase activity assays: Importance
of zymography. J Pharmacol Toxicol. 2010;61(2):205-9.
55. Givvimani S, Kundu S, Narayanan N, Armaghan F, Qipshidze N, Pushpakumar S, et al. TIMP-2 mutant decreases
MMP-2 activity and augments pressure overload induced LV dysfunction and heart failure. Arch Physiol Biochem.
2013;119(2):65-74.
56. Montaner J, Alvarez-Sabin J, Molina C, Angles A, Abilleira S, Arenillas J, et al. Matrix metalloproteinase
expression after human cardioembolic stroke - Temporal profile and relation to neurological impairment. Stroke.
2001;32(8):1759-66.
57. Montaner J, Alvarez-Sabin J, Molina CA, Angles A, Abilleira S, Arenillas J, et al. Matrix metalloproteinase
expression is related to hemorrhagic transformation after cardioembolic stroke. Stroke. 2001;32(12):2762-7.
50
58. Fagan SC, Cronic LE, Hess DC. Minocycline Development for Acute Ischemic Stroke. Transl Stroke Res.
2011;2(2):202-8.
59. Yang Y, Estrada EY, Thompson JF, Liu WL, Rosenberg GA. Matrix metalloproteinase-mediated disruption of
tight junction proteins in cerebral vessels is reversed by synthetic matrix metalloproteinase inhibitor in focal ischemia
in rat. J Cerebr Blood F Met. 2007;27(4):697-709.
60. Hartz AMS, Bauer B, Soldner ELB, Wolf A, Boy S, Backhaus R, et al. Amyloid-beta Contributes to Blood-Brain
Barrier Leakage in Transgenic Human Amyloid Precursor Protein Mice and in Humans With Cerebral Amyloid
Angiopathy. Stroke. 2012;43(2):514-23.
61. Chang DI, Hosomi T, Lucero J, Heo JH, Abumiya J, Mazar IP, et al. Activation systems for latent matrix
metalloproteinase-2 are upregulated immediately after focal cerebral ischemia. J Cerebr Blood F Met.
2003;23(12):1408-19.
62. Le NTV, Xue ML, Castelnoble LA, Jackson CJ. The dual personalities of matrix metalloproteinases in
inflammation. Front Biosci. 2007;12:1475-87.
63. Chiu PS, Lai SC. Matrix metalloproteinase-9 leads to blood-brain barrier leakage in mice with eosinophilic
meningoencephalitis caused by Angiostrongylus cantonensis. Acta Trop. 2014;140:141-50.
64. Gidday JM, Gasche YG, Copin JC, Shah AR, Perez RS, Shapiro SD, et al. Leukocyte-derived matrix
metalloproteinase-9 mediates blood-brain barrier breakdown and is proinflammatory after transient focal cerebral
ischemia. Am J Physiol-Heart C. 2005;289(2):H558-H68.
65. Ovechkin AV, Tyagi N, Rodriguez WE, Hayden MR, Moshal KS, Tyagi SC. Role of matrix metalloproteinase-9
in endothelial apoptosis in chronic heart failure in mice. J Appl Physiol. 2005;99(6):2398-405.
66. Buhler LA, Samara R, Guzman E, Wilson CL, Krizanac-Bengez L, Janigro D, et al. Matrix metalloproteinase-7
facilitates immune access to the CNS in experimental autoimmune encephalomyelitis. Bmc Neurosci. 2009;10.
67. Banda MJ, Rice AG, Griffin GL, Senior RM. Alpha-1-Proteinase Inhibitor Is a Neutrophil Chemoattractant after
Proteolytic Inactivation by Macrophage Elastase. J Biol Chem. 1988;263(9):4481-4.
68. De Vuyst E, Decrock E, De Bock M, Yamasaki H, Naus CC, Evans WH, et al. Connexin hemichannels and gap
junction channels are differentially influenced by lipopolysaccharide and basic fibroblast growth factor. Mol Biol Cell.
2007;18(1):34-46.
69. Woessner JF, Taplin CJ. Purification and Properties of a Small Latent Matrix Metalloproteinase of the Rat Uterus.
J Biol Chem. 1988;263(32):16918-25.
70. Hu X, Beeton C. Detection of functional matrix metalloproteinases by zymography. Journal of visualized
experiments : JoVE. 2010(45).
71. Solan JL, Lampe PD. Specific Cx43 phosphorylation events regulate gap junction turnover in vivo. Febs Lett.
2014;588(8):1423-9.
72. Lampe PD, Lau AF. The effects of connexin phosphorylation on gap junctional communication. Int J Biochem
Cell B. 2004;36(7):1171-86.
73. Anthony DC, Ferguson B, Matyzak MK, Miller KM, Esiri MM, Perry VH. Differential matrix metalloproteinase
expression in cases of multiple sclerosis and stroke. Neuropath Appl Neuro. 1997;23(5):406-15.
74. Clark AW, Krekoski CA, Bou SS, Chapman KR, Edwards DR. Increased gelatinase A (MMP-2) and gelatinase B
(MMP-9) activities in human brain after focal ischemia. Neurosci Lett. 1997;238(1-2):53-6.
75. Chang CC, Tien CH, Lee EJ, Juan WS, Chen YH, Hung YC, et al. Melatonin inhibits matrix metalloproteinase-9
(MMP-9) activation in the lipopolysaccharide (LPS)-stimulated RAW 264.7 and BV2 cells and a mouse model of
meningitis. J Pineal Res. 2012;53(2):188-97.
76. Yu WH, Woessner JF. Heparin-enhanced zymographic detection of matrilysin and collagenases. Anal Biochem.
2001;293(1):38-42.
77. Peracchia C, Wang XG. Connexin domains relevant to the chemical gating of gap junction channels. Braz J Med
Biol Res. 1997;30(5):577-90.
78. Peracchia C. Chemical gating of gap junction channels; roles of calcium, pH and calmodulin. Biochimica et
biophysica acta. 2004;1662(1-2):61-80.
79. Zhou L, Kasperek EM, Nicholson BJ. Dissection of the molecular basis of pp60(v-src) induced gating of connexin
43 gap junction channels. J Cell Biol. 1999;144(5):1033-45.
51
ADDENDUM: SAMENSTELLING BUFFERS EN MEDIA
RBE4 cultuurmedium
α-minimum essentieel medium (αMEM)/Ham’s F10 (Invitrogen)
10% foetaal kalfserum (Invitrogen)
Glutamine (Life Technologies, Merelbeke, België)
Geneticine (Life Technologies, Merelbeke, België)
humaan recombinant basische fibroblast groei factor (Roche Diagnostics, Indianapolis, USA)
Trypsine-EDTA (Invitrogen)
Trypsine is een protease dat cel-cel en cel-substraat contacten verbreekt. Gecombineerd met
EDTA (een calciumchelator) zorgt dit voor het loskomen van de cellen
HBSS-HEPES
MgSO4.7H2O 0.81 mM (VWR international)
CaCl2.2H2O 0.95 mM (VWR international)
NaCl 137 mM (VWR international)
Na2HPO4.2H2O 0.18 mM (VWR international)
KCl 5.36 mM (Merck)
KH2PO4 0.44 mM (VWR international)
D-glucose 5.55 mM (VWR international)
HEPES 25 mM (Sigma-Aldrich)
in dH2O; pH = 7.4
Ca2+ vrije buffer
KCl (5,36 mM)
KH2PO4 (0,44 mM)
NaCl (137 mM)
Na2HPO4.2H20 (0,18 mM)
EGTA (4,47 mM)
HEPES (25 mM)
52
Glucose (5,55 mM)
In dH2O; op pH 7,4 brengen
SLDT buffer
NaCl 137 mM (VWR international)
KCl 5.36 mM (Merck)
MgCl2 0.81 mM (VWR international)
D-glucose 5.55 mM (VWR international)
HEPES 25 mM (Sigma-Aldrich)
in dH2O; pH = 7.4
PBSD+
NaCl 137 mM (VWR international)
KCl 2,68 mM (VWR international)
CaCl2 0,90 mM (VWR international)
MgCl2.6H20 0,334 mM (VWR international)
KH2PO4 1,47 mM (VWR international)
Na2HPO4.2H2O 6,46 mM (VWR international)
in dH2O; pH = 7,4
RIPA buffer
Tris (pH 8,2) 25 mM ( Sigma-aldrich, Bornem België)
NaCl 50 mM (VWR international)
NP40 0,5 % (Sigma-aldrich)
Deoxycholaat 0,5% (Sigma-aldrich)
SDS 0,1% (Sigma-aldrich)
Toevoegen vlak voor gebruik:
- 20 µL van een mini-EDTA free protease tablet (Roche Diagnostics) opgelost in dH2O
- 0,055 g/ml β glycerolfosfaat (sigma-aldrich)
- 1µL/mL 1M DTT (eindconcentratie is 1mM) (Sigma-aldrich)
- 20 µL/mL Standaard fosfatase inhibitor cocktail (Sigma-aldrich)
53
Blotbuffer
Methanol 200mL (VWR international)
Tris 25 mM (Sigma Aldrich)
Glycine 192 mM (Sigma Aldrich)
20% SDS 1,75 ml (BioRad)
Aanlengen met 1L dH20
Blokbuffer
5% melkpoeder (Nestlé, Vevey, Nieuw-Zeeland) of 3% BSA (Sigma Aldrich)
0,1% Tween20 (Sigma Aldrich)
10x TBS (Tris buffered saline)
50 mM Tris (Sigma Aldrich)
150 mM NaCl (VWR international)
Geheel aanlengen met dH20; pH 7,6
Running gel (20 mL)
dH20 7,9mL
30% PAA 6,7 mL (Biorad)
1,5M Tris (pH 8,8) 5,0 mL (Sigma)
10% SDS 0,2 mL (Biorad)
10% APS 0,2 mL (Sigma)
TEMED 0,008 mL (Biorad)
10 mg/mL gelatine 2,0 mL
Stacking gel (5mL)
dH20 3,4 mL
30% PAA 0,83 mL
1,5 m Tris (pH 6,8) 0,63 mL
10% SDS 0,05 mL
10% APS 0,05 mL
TEMED 0,005 mL
54
Tris-Glycine SDS running buffer Zymogram (10x)
Tris 29 g
Glycine 144 g
SDS 10 g
aanlengen in 1L dH20
Developing buffer Zymogram (10x)
Tris 12,1g
Tris-HCl 63g
NaCl 117 g
CaCl2 7,4 g
Brij35 0,2 %
aanlengen in 1L dH20
Staining solution Zymogram
Coomassie Blauw 0,2%
Methanol 450 mL (UCB S.A., Belgium)
Azijnzuur 100 mL (Sigma aldrich)
dH20 400 mL
Destaining solution Zymogram
Methanol 450 mL
Azijnzuur 100 mL
dH20 400 mL
55
ADDENDUM: STRUCTUUR CHEMISCHE AGENTIA
Propidium iodide (Invitrogen)
Is een membraan-impermeabele, fluorescente molecule met moleculaire massa van 668,4 Da.
Wanneer PI bindt aan nucleïnezuren in de celkern heeft het een excitatie fluorescentie maximum
van 535 nm en een emissie maximum van 617 nm.
Hoechst (Invitrogen)
Hoechst is een fluorescente kleurstof die geëxciteerd wordt met UV licht rond 350 nm en een blauw
licht uitzend met een emissie maximum rond 461 nm. Hoechst is een celpermeabele kleurstof die
dubbelstrengig DNA kan binden in levende of gefixeerde cellen.
6-carboxyfluoresceïne (Teflabs, Austin, TX, USA)
6-Carboxyfluoresceïne (6-CF) is een fluorescente kleurstof welke geëxciteerd wordt door
56
licht in het blauwe golflengtegebied (λ=494 nm) en daarbij groen emissielicht (λ=518 nm)
uitstraalt. Het moleculair gewicht (MW) van deze molecule is 376.322 Da, klein genoeg dus
om door gap juncties te kunnen worden doorgegeven.
Probenecid (Invitrogen)
Probenecid is een efflux blokkerende agent die ervoor zorgt dat multidrug resistance transporters
zoals p-glycoproteïne die sterk aanwezig zijn in BHB endotheel fluo-4AM niet uit te cel kan
transporteren alvorens AM afgekliefd wordt.
fluo-4AM (Life Technologies, Merelbeke, België)
Fluo-4AM is een Ca2+ indicator omdat het een verhoogde fluorescentie intensiteit vertoont wanneer
het bindt aan Ca2+. Omdat fluo-4 op zichzelf de cel niet kan penetreren wordt de acetoxymethyl
(AM) ester toegevoegd die wel in staat is de cel te penetreren. Eenmaal binnen de cel wordt AM
geknipt door onspecifieke esterasen waardoor fluo-4 in de cel vastzit.