Epidemiologische Datenerhebung von bisphosphonat ...
Transcript of Epidemiologische Datenerhebung von bisphosphonat ...

Epidemiologische Datenerhebung
von bisphosphonat-assoziierten Kiefernekrosen
im Patientengut
der Mund-, Kiefer- und Gesichtschirurgischen Klinik
der Friedrich-Alexander-Universität
Erlangen-Nürnberg
Zur Erlangung des Doktorgrades Dr. med. dent
vorgelegt von
Ricarda Müller
aus Leipzig

Als Dissertation genehmigt von der
Medizinischen Fakultät der Friedrich-Alexander-Universität
Erlangen-Nürnberg
Tag der mündlichen Prüfung: 18. Januar 2016
Vorsitzender des Promotionsorgans: Prof. Dr. Dr. h.c. J. Schüttler
Gutachter: PD Dr. Dr. P. Stockmann
Gutachter: Prof. Dr. Dr. Dr. h.c. F. Neukam

Inhaltsverzeichnis
1 Zusammenfassung ......................................................................................................... 1
1.1 Zusammenfassung .................................................................................................. 1 1.2 Summary ................................................................................................................. 4
2 Einleitung ...................................................................................................................... 7 2.1 Wirkungsmechanismus der Bisphosphonate .......................................................... 8 2.2 Krankheitsbild der Bisphosphonat - assoziierten Knochennekrose ....................... 9
2.3 Risikofaktoren ...................................................................................................... 10 3 Methodik ...................................................................................................................... 14
3.1 Studienkollektiv .................................................................................................... 14
3.2 Studienablauf ........................................................................................................ 15 3.3 Klinisches Staging ................................................................................................ 15
3.3.1 Der Basisfragebogen...................................................................................... 15 3.3.2 Der Follow-up-Bogen .................................................................................... 16
3.4 Statistische Methoden ........................................................................................... 17 4 Ergebnisse .................................................................................................................... 19
4.1 Alter ...................................................................................................................... 19 4.2 Risiken und allgemeine Erkrankungen ................................................................. 21 4.3 Grunderkrankung .................................................................................................. 22
4.3.1 Demographie und Grunderkrankung ............................................................. 24 4.4 Medikamente ........................................................................................................ 24
4.5 Chemostatika, Zytostatika .................................................................................... 25 4.6 Bisphosphonat ...................................................................................................... 25
4.6.1 Alter, Geschlecht und Bisphosphonat ........................................................... 28 4.6.2 Grunderkrankung und Bisphosphonat ........................................................... 31
4.7 Nekrosefreiheitsrate .............................................................................................. 35
4.7.1 Alter, Geschlecht und Nekrosefreiheitsrate ................................................... 36
4.7.2 Zytostatika und Nekrose ................................................................................ 39 4.7.3 Bisphosphonat-Therapie und Nekrose........................................................... 41 4.7.4 Multivariate Nekrosefreiheit.......................................................................... 45
4.8 Befund bei Baseline-Untersuchung ...................................................................... 46 4.8.1 Geschlecht, Alter und Nekrosebefund bei Baseline ...................................... 50
4.8.2 Allgemeine Erkrankungen, Risiken und Nekrosebefund bei Baseline ......... 51 4.9 Auslöser der Nekrose............................................................................................ 53
4.9.1 Alter, Geschlecht und chirurgischer Eingriff ................................................ 54 4.9.2 Grunderkrankung und chirurgischer Eingriff ................................................ 55 4.9.3 BIS und Auslöser ........................................................................................... 55
4.10 Symptome und Befund der Nekrose ................................................................... 55 4.11 Nekrosetherapie und follow up........................................................................... 58
4.12 Follow up ............................................................................................................ 58 5 Diskussion ................................................................................................................... 62 6 Anhang ........................................................................................................................ 67
6.1 Abbildungsverzeichnis ......................................................................................... 67 6.2 Tabellenverzeichnis .............................................................................................. 68 6.3 Abkürzungsverzeichnis ........................................................................................ 69

7 Danksagung ................................................................................................................. 70
8 Lebenslauf ................................................................................................................... 71 9 Erklärung ..................................................................................................................... 72 10 Literaturverzeichnis ................................................................................................... 73

1
1 Zusammenfassung
1.1 Zusammenfassung
Die vorliegende Studie erfasst Daten von insgesamt 150 Patienten, welche zum Großteil
prospektiv während der wöchentlich stattfindenden Bisphosphonat-Sprechstunde in der
Mund-Kiefer-Gesichtschirurgie des Universitätsklinikums Erlangen zwischen März
2009 und Dezember 2011 erhoben worden. Zudem wurden Datensätze von langjährig
betreuten Patienten mit deren Einwilligung retrospektiv statistisch erfasst. Somit ergibt
sich eine Beobachtungszeit von bis zu 11 Jahren. Es lassen sich dementsprechend
Aussagen über die Langzeittherapie ableiten.
Die Mehrheit mit 63% der Studieneilnehmer waren Frauen (n=95), folglich gab es 55
männliche Patienten (37%). Das Alter reichte von 18 bis 89 Jahren, wobei das
Durchschnittsalter 64 Jahre betrug.
Bisphoshonate werden bei strenger Indikationsstellung verabreicht, Beispiele sind
Tumorleiden, welche zu ossären Metastasen führen können und Osteoporose. In dieser
Studie waren die drei häufigsten Grunderkrankungen, die zur BIS-Therapie führten
Mammakarzinom (n=67), Osteoporose (n=35) und das Prostatakarzinom (n=21).
Die Therapie konnte intravenös oder oral erfolgen. Bei 103 Patienten wurde die
intravenöse Applikationsform gewählt, neun wurden oral therapiert. Zumeist (n=74)
erfolgte die Applikation monatlich, am zweithäufigsten (n=24) wurde das jährliche
Intervall gewählt. Im Intervall verzeichnete man hoch signifikante Unterschiede bei
beiden Geschlechtern. Die Männer wurden mit 95% fast ausschließlich monatlich mit
BIS therapiert, bei den Frauen waren es monatlich 55% und jährlich 30%. Das
Bisphosphonat der Wahl war Zoledronat (n=84, 74%), gefolgt von Pamidronat (n=8,
7%). Risedronat und Alendronat wurden nur bei Osteoporose-Patienten appliziert.
Auffällig war zudem, dass sieben von den neun oral Therapierten an Osteoporose litten.
Ein weiterer Unterschied in der Therapie zu Patienten mit maligner Grunderkrankung
ist, dass bei 86% die BIS-Applikation wöchentlich erfolgte.
Der Begriff “Nekrosefreiheitsrate”(NFR) beschreibt das statistische Fernbleiben einer
BONJ trotz BIS-Therapie. Es ließen sich deutliche Unterschiede zwischen den
Geschlechtern bezüglich der Nekrosefreiheitsrate feststellen. Nach fünf Jahren unter

2
Bisphosphonat-Therapie wiesen die Frauen eine NFR von 68,5% auf, bei den Männern
lag sie mit 42,5% deutlich darunter.
Auch bei der Applikationsform gab es nach fünf Jahren deutliche Unterschiede in der
NFR. Die Gruppe der intravenös Behandelten wiesen eine NFR von 61,5% auf, die oral
Therapierten eine von 43%. Auf die sehr ungleiche Gruppenstärke (i.v.:103, oral:9) sei
an dieser Stelle noch einmal verwiesen.
Das Intervall, in welchem das BIS verabreicht wird, hat ebenso einen Einfluss auf die
NFR. Alle 24 Patienten, die nur einmal im Jahr Bisphosponate verabreicht bekamen,
entwickelten während der gesamten Studienzeit keine BONJ. Die Nekrosefreiheitsrate
betrug 100%. Alle anderen Intervalle (zusammengefasst unter kürzer als jährlich-
Gruppe, siehe Tabelle 19) wiesen nach fünf Jahren eine NFR von 55% auf.
Das Hauptziel dieser Studie war herauszufinden, welche Auslöser zu einer BONJ
führen. Dafür wurde eine multivariate Statistik nach Cox erstellt, welche zehn
Prediktoren enthielt. Diese waren das Alter, das Geschlecht, Nikotinabusus, das Vorlie-
gen einer Nierenerkrankung, Osteoporose als Grunderkrankung, die orale Einnahme des
Bisphosphonats, das jährliche Intervall für die BIS-Applikation, die zusätzliche Ein-
nahme von Zytostatika und das Therapieren mit dem Bisphosphonat Zoledronat oder
Risedronat. Einer der drei Hauptrisikofaktoren ist das männliche Geschlecht. Männer
haben ein 0,2-0,5fach höheres Risiko eine BONJ zu entwickeln. Desweiteren führte eine
zusätzliche Zytostatika-Einnahme zu einem vierfach erhöhten Risiko an einer BIS-
Nekrose zu erkranken. Der dritte signifikante Prediktor ist das BIS-Präparat Risedronat.
Patienten, welche damit therapiert wurden, hatten ein siebenfach höheres Risiko eine
BONJ zu entwickeln.
Insgesamt wurden während der Studienzeit 28 Nekrosepatienten untersucht. Verglichen
mit den anderen Patienten dieser Studie war die Nekrose-Gruppe mit im Schnitt 67
Jahren die älteste.
Die direkten Auslöser einer BONJ waren mit 18 von 28 an einer BIS-Nekrose Erkrank-
ten am häufigsten die Zahnextraktion an der später nekrotisierten Region. Weitere
Auslöser waren Druckstellen (n=9), eine Implantatinsertion und Parodontitisbehandlung
mit je drei Patienten. Gemeinsam war diesen drei Patienten, dass sie weiblich waren,
und als Grunderkrankung ein Mammakarzinom vorlag.
Von Bedeutung für die Therapie und des damit verbundenen Aufwandes ist das
Nekrosestadium. Nur knapp 4% stellten sich im ersten Stadium bei uns vor, die

3
Mehrheit stellte sich im Stadium zwei und drei vor (je n=fast 43%). Elf Prozent kamen
erst im Endstadium. Dementsprechend invasiver und aufwendiger ist die Therapie. In
20 Fällen wurde eine Sequesterotomie vorgenommen, bei 16 Patienten wurde eine
Antibiose eingeleitet und 15 mal erfolgte ein plastischer Wundverschluss. In den
meisten Fällen wurden mehrere Therapiemöglichkeiten kombiniert.
Um eine Neuerkrankung oder mögliche Rezidive einer BONJ frühzeitig zu erkennen,
wurden die Patienten in ein halbjährliches Follow-up eingeschleust. Während der Stu-
dienzeit nahmen nur 43% die empfohlene Nachsorge war. Zukünftig sollte eine umfang-
reichere Aufklärung der Patienten seitens der Haus- und Zahnärzte über die zum Teil
gravierenden Nebenwirkungen der Bisphosphonattherapie im Bereich der Kiefer erfol-
gen. Ziel ist es, die Patienten stärker auf die möglichen Symptome einer BONJ zu sen-
sibilisieren und für die Verlaufskontrollen zu motivieren.

4
1.2 Summary
This study collected data from a total of 150 patients who were largely recruited during
the weekly bisphosphonate consultation in the oral and maxillofacial surgery at the
University Hospital Erlangen between March 2009 and December 2011. In addition,
statistical records of long-standing patients who gave their consent were recorded retro-
spectively. This results in an observational time period of up to eleven years and there-
fore the assertions can be considered from the perspective of long-term therapy.
The majority (63%) of the study participants were women (n = 95), and consequently
there were 55 male patients (37%). The ages ranged from 18 to 89 years. The average
age was 64 years.
Bisphosphonates were administered only with strong indication of need; examples are
tumor diseases, which could lead to bone metastases and osteoporosis. In this study the
three most common underlying conditions that led to BIS therapy were breast cancer
(n = 67), osteoporosis (n = 35) and prostate cancer (n = 21).
The therapy could be administered intravenously or orally. In 103 patients, the intrave-
nous application was selected, while nine were treated orally. In most cases (n = 74) the
application was administered monthly, with the second highest number (n = 24) of ap-
plications administered annually. In the interval we recorded highly significant differ-
ences in both sexes. 95% of the men were treated with BIS monthly, while among
women 55% were treated monthly and 30% annually. The bisphosphonate of choice
was Zoledronate (n = 84, 74%), followed by Pamidronate (n = 8, 7%). Risedronate and
Alendronate were administered only in patients with osteoporosis. It is also noteworthy
that seven of nine patients who were treated orally suffered from osteoporosis. Another
difference in the treatment for patients with malignant disease is that 86% of the BIS
application was carried out weekly.
The term "Nekrosefreiheitsrate" (NFR) describes the statistical absence of BONJ de-
spite BIS therapy. It can be stated with regard to the NFR that significant differences
exist between the sexes. After five years under bisphosphonate therapy the women
showed an NFR of 68.5%, while for men the rate was 42.5%.
There were also significant differences in the NFR after five years which were depend-
ent upon means of application. The group of treated intravenously had an NFR of

5
61.5 %, while orally treated patients had a 43% rate. The very unequal group sizes (in-
travenously: 103, orally: 9) should once again be pointed out.
The interval in which the BIS is administered also has an influence on the NFR. None
of 24 patients who were administered bisphosphonates only once a year developed
BONJ throughout the study period. Their NFR was 100%. All other intervals (collec-
tively shorter than a year group, see Table 19) exhibited a 55% NFR rate after five
years.
The main aim of this study was to find out what triggers lead to a BONJ. A multivariate
statistical analysis similar to the one used by Cox was created, which contained ten pre-
dictors. These were age, sex, smoking, presence of kidney disease, osteoporosis as un-
derlying disease, oral ingestion of the bisphosphonate, the annual interval for the BIS
application, the additional administration of cytostatics and therapy with the bisphos-
phonate Zoledronate or Risedronate. One of the three main risk factors is the male sex.
Men have a 0.2 times to 0.5 times greater risk of developing a BONJ. Furthermore, an
additional treatment with a cytostatic led to a fourfold increased risk of developing a
BONJ. The third significant predictor is the BIS preparation Risedronate. Patients who
were treated with it had a seven times higher risk to develop a BONJ.
A total of 28 patients with BONJ were examined during the study period. The necrosis
group had an average age of 67 and was thus the oldest average group in the study. The
direct cause of BONJ in 18 of 28 patients with BONJ was most commonly tooth extrac-
tion at the region that later turned necrotic. Other triggers were bruises (n = 9), and im-
plant placement and treatment of periodontitis with just three patients. These three pa-
tients were all female and had breast cancer as their primary disease.
The stage of necrosis is of importance for the therapy and the associated costs. Only
about 4% of the patients came to us during the first stage with the majority coming dur-
ing stage two and three (n = almost 43%). Eleven percent came only in the final stage.
The later the stage of necrosis, the more invasive and more expensive the therapy. In 20
cases a sequestrotomy was performed, in 16 patients an antibiotic was initiated and a
plastic wound closure was used 15 times. In most cases several kinds of therapy were
combined. In order to detect new cases or possible recurrences of BONJ early, patients
were introduced into a semi-annual follow-up. During the study only 43% participated
in the recommended follow-up. In the future there should be a comprehensive education
process for the patients given by their general practitioner or dentist to explain the seri-

6
ous side effects of the Bisphosphonate therapy that can occur in the jawbone. The aim is
to make the patients aware of the possible symptoms of BONJ to motivate them to par-
ticipate in follow-up examinations.

7
2 Einleitung
Die Bisphosphonat-assoziierte Kiefernekrose (BONJ - Bisphosphonate Related
Osteonecrosis of the Jaw) wurde erstmals von Marx im Jahre 2003 beschrieben [1].
Patienten unter Bisphosphonattherapie, welche exponierten Kieferknochen über acht
Wochen ohne Selbstheilung aufweisen, ohne dass eine kraniofaziale Radiatio erfolgte,
leiden laut Definition unter einer BONJ [2,3].
Speziell seit der Einführung der intravenös zu verabreichenden, hochpotenten
Aminobisphosphonate (Zoledronat, Pamidronat) in das tumortherapeutische
Behandlungskonzept bei Knochenmetastasen, sind zunehmend Kasus mit freiliegendem
Kieferknochen zu verzeichnen. Heutzutage sind die Bisphosphonate das am meisten
verschriebene Medikament bei Erkrankungen mit fortgeschrittener Knochenresorption
und ossären Metastasen [4] und kommen als Therapiemittel unter anderem gegen
Osteoporose, Plasmozytom, Mamma- und Prostatakarzinom erfolgreich zum Einsatz.
Bei einer malignen Grunderkrankung liegt die Inzidenz einer BONJ bei 5% [5].
Osteoporosepatienten können von einem kleineren Risiko einer Neuerkrankung
ausgehen.
Zum jetzigen Zeitpunkt ist die Ätiologie der BONJ noch immer ungeklärt. Es ist das
Ziel des Projektes, epidemiologische Daten zur bisphosphonat-assoziierten
Knochennekrose der Kiefer mit Hilfe einer standardisierten, internet-basierten Plattform
zu sammeln und systematisch aufzuarbeiten. Die Dissertation soll Aufschluss über die
Erfolgsrate der jeweiligen Behandlungsstrategien geben und zur Risikostratifizierung
des Krankheitsbildes beitragen. Welche Therapiedauer, welches Bisphosphonat, welche
Applikationsform führen häufiger zu einer BONJ? Stellt das Geschlecht oder das Alter
des Patienten eine Prädestination dar? Wie ist es um die Compliance des Patienten und
die regelmäßige Teilnahme der Follow-up-Untersuchungen bestellt? Durch
Einbeziehung einer Kontrollgruppe soll der Einfluss bekannter Kofaktoren überprüft
und mögliche weitere Kofaktoren identifiziert werden.

8
2.1 Wirkungsmechanismus der Bisphosphonate
Bisphosphonate sind Analoga des physiologischen Pyrophosphates, das Salz der
Phosphorsäure, welches aus der Kondensation zweier Phosphatmoleküle hervorgeht.
Diese körpereigene Verbindung, welche sich im Molekül als P-O-P-Bindung darstellt,
nimmt bei zellulären Energieübertragungsprozessen eine Schlüsselrolle ein.
Der Austausch eines Sauerstoffatoms gegen ein Kohlenstoffatom (P-C-P) macht die
Bisphosphonatverbindung stabil gegenüber hydrolytischer oder enzymatischer
Spaltung, wobei allerdings die physiko-chemischen Eigenschaften der Pyrophosphate
erhalten bleiben [6].
Die Substanzgruppe wird intestinal nur gering resorbiert und unverändert über die
Nieren eliminiert. Bisphosphonate inhibieren vor allem die Knochenresorption durch
Hemmung der Osteoklasten und besitzen dadurch einen bedeutenden Effekt auf den
Kalziumstoffwechsel [7]. Sie haben aufgrund ihrer chemischen Struktur und unabhängig
vom Applikationsweg eine hohe Bindungsaffinität zur Knochenoberfläche, an welcher
sie kovalent an Hydroxylapatit binden [8]. Durch diesen Wirkmechanismus und die nicht
vorhandene Metabolisierung resultiert eine sehr lange Eliminationshalbwertszeit der
Bisphosphonate in vivo von mehreren Jahren [9].
Die Knochenresorption wird vor allem durch eine direkte Einwirkung auf die
Osteoklasten gehemmt. Auf diese Weise wird die Rekrutierung der Osteoklasten und
deren resorptive Aktivität auf der Knochenoberfläche inhibiert, zudem werden
apoptotische Vorgänge induziert. Nicht stickstoffhaltige Bisphosphonate scheinen dies
über die Bildung toxischer ATP-Analoga zu bewirken. Aminobisphosphonate wirken
über die Hemmung eines Enzyms (Farnesylpyrophosphat-Synthase), dessen
Spaltprodukte wichtig für die physiologische Osteoklastenreifung sind. Durch die
Hemmung aktiver Osteoklasten und der damit verbundenen reduzierten Freisetzung von
Bone morphogenic protein (BMP) und Insulin-like growth factors wird als indirekte
Folge die Entwicklung von Osteoblasten aus mesenchymalen Stammzellen und damit
die Osteoneogenese zusätzlich gemindert. In Regionen mit gesteigertem
Knochenumbau (z. B. dem Kieferknochen) ist die Wirkung der Bisphosphonate
aufgrund der gesteigerten Osteoklastenaktivität besonders hoch.

9
2.2 Krankheitsbild der Bisphosphonat - assoziierten Knochennekrose
Neben unspezifischen Nebenwirkungen wie Kopfschmerzen, Uveitis, Affektionen im
Gastrointestinaltrakt, muskuloskelettalen Symptomen, allergischen Reaktionen und
Akute-Phase-Reaktionen (Myalgie, Unwohlsein, Fieber), ist seit dem Jahre 2003 die
Osteonekrose der Kiefer als Komplikation beschrieben. Das als Bisphosphonat-
assoziierte Kieferknochennekrose (BONJ) beschriebene Krankheitsbild ist definiert als
exponierter Kieferknochen bei einem Patienten unter Therapie mit Bisphosphonaten,
welcher innerhalb von 8 Wochen nach Identifikation nicht abheilt ohne dass eine
Bestrahlung in der kraniofazialen Region erfolgte [2,3]. Bei der BONJ handelt es sich um
eine klinische Diagnose, da die zu erhebenden radiologischen und pathologischen
Befunde unspezifisch sind [10,11]. Neben dem Leitsymptom „exponierter nekrotischer
Kieferknochen“ sind Parästhesien im Innervationsgebiet des N. alveolaris inferior
(Vincent-Symptom), Schmerzen, Schwellungen und entzündliche Veränderungen im
Sinne von Abszessen, Fisteln und Sinusitiden richtungweisend bei der Diagnosestellung
[3,12,13].
Fundierte Daten zu Prävalenz und Verlauf der BONJ bei Tumorpatienten sind rar [14-18].
Die Inzidenz der Erkrankung wird zwischen 2% und 28% angegeben [14,16,17,19]. Diese
hohe Varianz der Werte impliziert, dass die klinischen Daten noch unvollständig sind.
Die vertreibenden Pharmafirmen weisen in der Packungsbeilage besonders auf diese
hier als „selten“ beschriebene Komplikation hin. Auffällig ist, dass zumeist hoch
potente stickstoffhaltige Bisphsophonate (Aminobisphosphonate), vor allem Zoledronat
(Zometa®, Novartis AG, Basel, Schweiz) und Pamidronat (Aredia®, Novartis AG,
Basel, Schweiz) gehäuft bei Patienten mit der Knochennekrose vergesellschaftet sind.
Legt man die Anzahl von geschätzten 2.500.000 Patienten, die mit intravenösen Amino-
Bisphosphonaten [20] behandelt werden zugrunde, so lässt sich die Relevanz dieses
Krankheitsbildes mit ca. 50.000 Erkrankungen weltweit für das Fachgebiet der Zahn-,
Mund- und Kieferheilkunde als erheblich beschreiben. Besondere Verantwortung tragen
neben den anwendenden Fachdisziplinen (Onkologie, Frauenheilkunde, Urologie,
Innere Medizin u.v.m.) die Zahn-, Mund- und Kieferheilkunde, deren hauptsächliche
Aufgabe in der Primär- und Sekundärprävention der Erkrankung besteht.
Eine effektive und evidenzbasierte Therapie der BONJ ist bisher nicht bekannt. Das
empfohlene Therapiespektrum reicht von konservativen Maßnahmen wie lang
dauernder Antibiotikagabe, desinfizierenden Mundspüllösungen über Anwendung von

10
hyperbarer Sauerstofftherapie und Laseranwendungen bis zur chirurgischen Kürretage
nekrotischer Knochenanteile [21-23], Fluoreszenz-orientierter Nekroseabtragung [24] und
radikalchirurgischen Eingriffen wie Kasten- oder Kontinuitätsresektionen [25].
Die Ergebnisse weniger prospektiver Studien weisen derzeit darauf hin, dass die BONJ
durch ein operatives Vorgehen besser zu therapieren ist als durch Einsatz konservativer
Maßnahmen [19,26-29]. Da am häufigsten Patienten mit malignen Grunderkrankungen
betroffen sind, bedarf es bei der Behandlung der BONJ einer repräsentativen
Gewebeprobe mit anschließender histologischer Aufarbeitung, um eine mögliche
maligne Ursache ausschließen zu können [23]. Zum gegenwärtigen Zeitpunkt ist die
exakte Ätiologie der BONJ unbekannt. Folgende Hypothesen sind in der Literatur zu
finden:
● Inhibierung der Osteoklasten- und Osteoblastenaktivität mit der Folge eines
gestörten Knochenturnover und kompromittierter Knochenheilung [30].
● Toxische Schleimhautschädigung mit sekundärer Freilegung des Knochens [5,31].
● Infektiös-immunologische Hypothese mit gestörter Infektabwehr an der
Schleimhautbarriere [5,11,31].
● Inhibition der endothelialen Zellen mit gestörter intraossärer Angiogenese[1,32-34].
Interessant ist, dass kürzlich mehrere Fälle von Osteonekrosen der Kiefer unter
Denosumab (Prolia®, Amgen, USA), einem humanen monoklonalen IgG-anti-RANKL-
Antikörper, und Bevacizumab (Avastin®, Roche-Pharma, Deutschland), einem
monoklonalen IgG-anti-VEGF-Antikörper, beschrieben wurden, die beide in den
komplexen Regelkreis des Knochenstoffwechsels eingreifen [35,36]. Somit erscheint der
Begriff der Bisphosphonat-assoziierten Knochennekrose nicht mehr zeitgemäß zu sein.
2.3 Risikofaktoren
Die Applikationsform (intravenös oder oral), die Dosis des Medikamentes, die
Therapiedauer und das Bisphosphonatpräparat haben Einfluss auf das individuelle
Risikoprofil eine BONJ zu entwickeln [14]. Daneben wird bei der BONJ von einem
multikausalen Geschehen ausgegangen, wie es auch für die Osteoradionekrose

11
beschrieben wurde [37-41]. Die Kombination einer Bisphosphonat-Medikation mit
mindestens einem der folgenden Faktoren wurde bisher als Risikofaktor für die
Entstehung einer BONJ beschrieben [3,42] :
dentale Pathologien (apikale und marginale Parodontitis, Periimplantitis, kariöse
Läsionen),
enorale Weichteil-Knochen-Wunden,
systemische Chemotherapeutika,
immunsuppressive Therapie und/oder
Steroid-Langzeittherapie
Alkohol und Nikotinabusus
Diabetes mellitus
Adipositas
Hypoxämie oder Anämie
Auf dieser Grundlage wurde durch Experten-Panels eine grobe Einteilung der Patienten
unter Bisphosphonattherapie in zwei Risikogruppen vorgeschlagen [40,41].
Hochrisikopatienten befinden sich unter intravenöser Bisphosphonattherapie und
zusätzlicher Chemo-, Strahlen- oder Kortikosteroidtherapie. Nahezu alle
Tumorpatienten fallen demnach in diese Risikogruppe. Am häufigsten sind Patienten
mit Multiplem Myelom (Plasmozytom) und Mamma-Karzinom betroffen, gefolgt von
Patienten mit Prostata-Karzinom [2]. Innerhalb dieser wichtigen Hauptgruppe ist
allerdings eine weitere Risikoabschätzung auf der Grundlage der bisher publizierten
Daten nicht möglich.
Patienten unter oraler Bisphosphonattherapie ohne begleitende Chemo-, Strahlen- oder
Kortikosteroidtherapie haben generell ein niedriges Risiko eine BONJ zu entwickeln.
Innerhalb dieser Gruppe tritt die BONJ mit einer Prävalenz zwischen 0,00038% und
0,04% auf [17,45].
Bei der retrospektiven Betrachtung von 119 Patienten mit BONJ identifizierte der
Erstbeschreiber des Krankheitsbildes, Robert E. Marx, 3 Patienten mit oraler
Medikation (Aledronat), die alle nach durchschnittlich 3 Jahren Applikationsdauer die
Nekrose entwickelten [30]. In Folgeuntersuchungen berichteten Marx und Mitarbeiter
über weitere 30 Fälle von Nekrosen unter oraler Medikation und konnten einen direkten
Zusammenhang zwischen dem Auftreten erster Symptome, Ausprägungsgrad der
Nekrose und Einnahmedauer oraler Bisphsophonate zeigen [30,46]. Diese Studien wurden

12
in einem Konsensuspaper der American Association of Oral and Maxillofacial Surgeons
(AAOMS) aufgegriffen und eine weitergehende Risikostratifizierung vorgeschlagen.
Hiernach werden zwei Risikogruppen von Patienten unter oraler Bisphosphonattherapie
unterschieden:
1. Bisphosphonattherapie über drei Jahre ohne weitere Risikofaktoren
2. Bisphosphonattherapie über weniger als drei Jahre, aber daneben
immunsuppressive Therapie (z.B. Steroidverordnungen)
Zur individuellen Risikoabschätzung wurde u.a. als Laborparameter die Bestimmung
des C-terminalen Kollagen Typ I-Telopeptides (CTX), ein biochemischer Marker des
Knochenstoffwechsels, zur Risikostratifizierung bei Patienten unter oraler
Bisphosphonattherapie vorgeschlagen [46,47]. Werte unter 100 pg/ml repräsentieren ein
hohes Risiko, CTX Werte zwischen 100 pg/ml und 150 pg/ml ein moderates Risko, und
Werte über 150 pg/ml repräsentieren ein minimales Risiko eine BONJ zu entwickeln.
Wegen der hohen intraindividuellen Tagesrhythmik der Werte ist dieser Marker jedoch
nur als Verlaufsparameter aussagekräftig. Ebenso hat die sehr aufwendige und teure
Bestimmung des CTX seinen Stellenwert in der Risikostratifizierung der BONJ noch
nicht etablieren können [43].
Es gibt Hinweise, dass genetische Determinanten, welche in den Prozess der
Knochenregeneration involviert sind, mit der Entwicklung einer BONJ assoziiert sind.
In einer genomweiten Analyse unter Einschluss von 22 Plasmozytompatienten mit
BONJ und 65 Kontrollpatienten konnten genetische Polymorphismen auf dem
Cytochrome P450-2C Gen (CYP2C8) dargestellt werden, die mit der Kiefernekrose
assoziiert auftreten [48]. Cytochrome P450 2C8 (CYP2 C8) gehört zur Familie der
Hämoproteine und ist verantwortlich für die Metabolisierung verschiedener
Arzneimittel (u.a. NSAR). Bisphosphonate werden jedoch im Körper ohne
physikalisch-chemische Modifikation über die Niere ausgeschieden, sodass durch die
Variabilität innerhalb des Cytochrome P450-Gens ein pathogenetischer Zusammenhang
zur BONJ nicht zu erklären ist. In eigenen Untersuchungen an 34 Patienten mit BONJ
und 139 gesunden Blutspendern zeigte sich eine signifikante Assoziation der BONJ mit
einem Polymorphismus auf dem Immunregulationsgen CTLA-4, welches bei
entzündlichen Erkrankungen aktiviert ist [49]. Dieses Ergebnis stützt die infektiös-
immunologische Hypothese der Entstehung der BONJ, welche von einer gestörten
Infektabwehr ausgeht, die über entzündliche Prozesse zur Knochennekrose führt.

13
Eine weitere Risikostratifizierung gelingt über die Tatsache, dass Aminobisphosphonat-
alterierter Kieferknochen klinisch und radiologisch das Bild einer Osteopetrose imitiert.
Pathognomonisch für Langzeit-Aminobisphosphonat-Applikation ist eine sichtbare
Hypersklerose des periodontalen Ligamentes [50].
In einer Vielzahl von Publikationen werden außerdem mögliche Kofaktoren genannt,
die zur Entwicklung einer BONJ beitragen können. Dies sind insbesondere
zahnärztliche Eingriffe, Parodontopathien, mechanische Reize (z.B.
Prothesendruckstellen), Fettleibigkeit, Rauchen oder besondere Begleitmedikationen,
wie beispielsweise Corticosteroide oder Chemotherapeutika [51-54]. Allerdings treten die
klinischen Symptome auch spontan auf, sodass zum jetzigen Zeitpunkt keine validierten
Aussagen bezüglich des Risikos, eine manifeste BONJ zu entwickeln, gemacht werden
können.
Hieraus leiteten sich erste Leitlinien zur Behandlung ab [2,11,55]. Ansätze zur Behandlung
der BONJ bestehen in der konservativen Behandlung mit Antibiotika und
desinfizierenden Lösungen über lokale Wundanfrischungen bis hin zur radikalen
Sequesterotomie unter stationären Bedingungen. An der MKG-Klinik Erlangen werden
Patienten abhängig vom Stadium der Grunderkrankung zumeist durch Sequesterotomie
behandelt, aber auch konservative Therapien sind durchgeführt worden.

14
3 Methodik
3.1 Studienkollektiv
Patienten wurden in die prospektive, vergleichende Studie eingeschlossen, wenn sie im
Rahmen der Sprechstunde für Patienten unter Bisphosphonattherapie an der Mund-,
Kiefer- und Gesichtschirurgischen Klinik der Friedrich Alexander Universität Erlangen-
Nürnberg zwischen dem 01.03.2009 und dem 31.12.2011 vorstellig wurden. Bereits vor
Februar 2009 erfasste Daten in der Bisphosphonatsprechstunde wurden mit
Einwilligung der Patienten in dieser Statistik erfasst, dementsprechend wird im
Folgenden von einer kombiniert retro- und prospektiven Studie geschrieben.
Zu den Einschlusskriterien gehörten:
- Einwilligung in die Studie
- Therapie mit oralen oder intravenös applizierten Bisphosphonaten.
Nach Einschluss in die Studie wurden die klinischen Daten der Patienten in einen
standardisierten Datenerfassungsbogen (Basisfragebogen) aufgenommen. Die
Aufnahme in die Studie wurde bei Patienten vorgenommen, welche Bisphosphonate
entweder oral oder intravenös in der Vergangenheit verabreicht bekamen, aktuell
bekommen oder im Rahmen der Voruntersuchung vor der ersten
Bisphosphonatapplikation in naher Zukunft bekommen. Diese dienen der Behandlung
ihrer Grunderkrankung (z.B. Mamma-, Prostatakarzinom, Plasmozytome) und/oder der
Prävention beziehungsweise Hemmung von ossären Metastasen.
Es gab keine Ausschlusskriterien bezüglich der Applikationsdauer, der
Applikationsintensität oder der Art des Bisphosphonats.

15
3.2 Studienablauf
Beginnend im März 2009 bis Dezember 2011 wurden im Rahmen der wöchentlich
stattfindenden Bisphosphonatsprechstunde Patientendaten prospektiv mithilfe eines
onlinebasierten, standardisierten Datenerfassungsbogen aufgenommen. Dieser setzt sich
aus einem Basiserfassungs- und einem Follow-up-Bogen zusammen, welche beide in
Zusammenarbeit mit der DÖSAK (Deutsch-Österreichisch-Schweizerischen
Arbeitskreises für Tumoren im Kiefer- und Gesichtsbereich) für dieses spezielle
Patientenklientel erstellt wurden.
Anschließend kam es zur Einspeisung aller Datensätze in eine multizentrische Online-
Datenbank. Diese ist unter https://bp-onj-datenbank.de/ einsehbar.
3.3 Klinisches Staging
Das klinische Staging setzt sich aus einem Basis- und Follow-up-Bogen zusammen.
3.3.1 Der Basisfragebogen
Jeder Patient wurde im Rahmen der Bisphosphonatsprechstunde zu seinen
personenbezogenen Daten befragt (Alter, Geschlecht, Grunderkrankung), welche der
Klassifikation dienen.
Die darauffolgende Anamnese lieferte spezielle Fakten zur Grunderkrankung, der
Medikation, einer eventuellen Radiatio und der Bisphosphonatapplikation.
Diese wurden mit den in den meisten Fällen vorliegenden Akten, Arztbriefen und
Datensätzen abgeglichen, komplettiert und ggf. aktualisiert.
Anschließend erfolgte eine klinische Untersuchung. Darin impliziert war eine extraorale
Betrachtung, eine Einteilung des Mundhygienestatus sowie ein ausführlicher Befund in
Form des DMF-T-Systems, welcher Taschentiefen und Lockerungen der Zähne enthielt.
Dieser gesamten Prozedur unterzog sich jeder Patient, der neu in die Studie
aufgenommen wurde.
Bei einer vorliegenden Bisphosphonat-assoziierten Kieferknochennekrose (BONJ)
werden zu den bereits vorhandenen Daten die klinischen Symptome und Lokalisation,

16
sowie mögliche auslösende Faktoren erfragt. Es erfolgt auch eine Einteilung in Stadien.
Die klinischen Stadien nach DÖSAK dienen zum Erfassen des Schweregrads einer
bereits vorliegenden BONJ in der Ausgangssituation und werden wie folgt eingeteilt:
Stadium 0 äußert sich asymptomatisch, es liegt also keine Kiefernekrose vor
Stadium 1 keine Beschwerden seitens der Patienten, obwohl klinisch bereits
intraorale Schleimhautläsionen oder freiliegender, nekrotischer Kieferknochen
festzustellen ist
Stadium 2 zeichnet sich entweder durch Beschwerden und/oder durch klinische
Entzündungszeichen mit freiliegendem Knochen aus
Stadium 3 alle unter Stadium 2 erläuterten klinischen Auffälligkeiten werden
dazu gezählt, wenn zusätzlich auch noch schwerwiegende weichteilige
Komplikationen im Sinne einer Abszedierung, extraoraler Fistelung, etc.
auftreten
Stadium 4 weist Symptome wie in Stadien 2 und 3 beschrieben auf, welche von
schwerwiegenden, knöchernen Komplikationen (im Sinne von Frakturen durch
inadäquates Trauma, MAV) oder Ausbreitung über die Kieferknochen hinaus
(z.B. Schädelknochen) begleitet werden
Um eine Stadieneinteilung zu ermöglichen, werden alle erfragten Daten zusammen mit
den klinisch relevanten Symptomen (Schmerzen, Sensibilitätsstörungen, Schwellung,
Rötung, Pus, pathologische Fraktur, Foetor ex ore, etc.) herangezogen.
Dieses Vorgehen ist wichtig, um den Schweregrad dieser Erkrankung auszumachen und
somit die dafür notwendige Therapie einzuleiten.
3.3.2 Der Follow-up-Bogen
Den Bisphosphonatpatienten wird eine halbjährliche Kontrolle empfohlen, da somit
eine mögliche Kieferknochennekrose aufgrund der Bisphosphonatapplikation oder
pathologische, enorale Schleimhautveränderungen in einem frühen Stadium erkannt und
sich somit unter geringer bis gar nicht invasiver Therapie behandeln lassen.
Um nicht noch einmal alle bereits bekannten Daten erfassen zu müssen, wurde ein auf
dem Basisfragebogen aufbauender Bogen verfasst. Dieser Follow-up-Bogen
klassifiziert den Patienten durch seine spezielle Krankengeschichte.

17
Zudem wird ein erneuter Zahn- und Mundhygienestatus mit klinischem Befund
erhoben, um mögliche enorale Schleimhaut- und Knochenveränderungen zu erkennen,
zu dokumentieren und zu therapieren.
Desweiteren wird auf eine mögliche Applikationsänderung oder –absetzung eingegan-
gen. Auch nach Absetzen des Bisphosphonats wird den Patienten angeraten die
halbjährlichen Kontrollen wahrzunehmen, da weiterhin das Risiko einer BONJ besteht.
Für Patienten, welche eine BONJ erlitten, wird das Behandlungsergebnis nach Therapie
bewertet. Zudem wird ein (erneutes) Vorliegen einer BONJ geklärt. Bei einem positiven
Befund, müssen auch hier wieder die Lokalisation, mögliche auslösende Faktoren sowie
Diagnostik und Therapie kritisch beleuchtet werden.
3.4 Statistische Methoden
Zur Beschreibung der Ergebnisse dieser kombinierten retro- und prospektiven,
deskriptiv projektierten Studie wurden folgende Tests verwendet:
Zur Beschreibung der Abhängigkeit zwischen zwei klassifizierten Variablen wurde im
Allgemeinen der Chi-Quadrat-Test nach der Maximum-Likelihood-Methode berechnet.
Bei zu geringer Feldbesetzung, genauer gesagt bei zu geringen Erwartungswerten wurde
bei einer 4-Felder-Tafel der exakte Chi-Quadrat-Test nach Fisher und Yates berechnet
und bei größeren Tafeln der exakten Chi-Quadrat-Test nach Mehta und Patel.
Mit dem U-Test nach Mann und Whitney wurde ein Messwert zwischen zwei Gruppen
verglichen, wenn keine Gaußsche Normalverteilung der Messwerte angenommen
werden kann. Wenn eine Gaußsche Normalverteilung der Messwerte angenommen
werden kann, wird statt dessen der mächtigere unverbundene t-Test verwendet. Bei
geringen Fallzahlen (unter 20 Patienten) wird anstelle des gewöhnlichen,
approximativen U-Tests der exakte U-Test gerechnet.
Überlebensstatistik nach Kaplan und Meier wurde wie folgend beschrieben angewandt:
aus der Beobachtungszeit der überlebenden Patienten und der Überlebenszeit der
verstorbenen ab einem bestimmten Zeitpunkt, hier ab BIS-Therapiebeginn, wird für alle
Zeitpunkte vom Beginn der Beobachtungszeit bis zum Ausscheiden des letzten
Patienten der Anteil derjenigen Patienten geschätzt, die zu diesem Zeitpunkt noch am

18
Leben sind. Diese geschätzte Überlebensrate umfasst auch solche Patienten, die bereits
vorher lebend ausgeschieden sind. Dieses Verfahren erlaubt auch den Vergleich der
Überlebensraten zwischen Gruppen. Zum Vergleich wird der log-rank Test berechnet.
Für mehr als zwei Gruppen, die eine Rangreihenfolge haben, wird zusätzlich der Test
auf Trend nach Tarone berechnet.
Ein Konfidenzintervall wird berechnet, um die Güte eines Schätzwertes zu beurteilen.
Der aus der Stichprobe ermittelte Schätzwert repräsentiert vermutlich nicht den
tatsächlichen Wert der Grundgesamtheit, und es ist kaum zu erwarten, dass er damit
exakt übereinstimmt. Man darf aber vermuten, dass der wahre Wert in der näheren
Umgebung des Schätzwertes liegt. Durch ein Konfidenzintervall (CI oder
Vertrauensbereich) wird dieser unscharfe Ausdruck „nähere Umgebung“ präzisiert, da
er einen Hinweis auf die Genauigkeit des errechneten Ergebnisses liefert und macht. Ein
95%-Konfidenzintervall gibt den Bereich an, der mit 95%-iger Wahrscheinlichkeit den
ermittelten Parameter überdeckt. Zur Überprüfung auf eine Gaußsche Normalverteilung
wurde die Probitdarstellung mit den Grenzen nach Lillefors verwendet.
Um die Testergebnisse quantitativ vergleichen zu können, wurden p-Werte berechnet.
Ein p-Wert unter 0,05 wird als signifikant bezeichnet und das Ergebnis wird als
wesentlich interpretiert. Die p-Werte werden wie gewohnt mit Stern-Symbolen
gekennzeichnet:
p < 0.05 mit *, p < 0,01 mit ** und p < 0,001 mit *** [56].

19
4 Ergebnisse
4.1 Alter
Diese Studie beschreibt 150 Patienten im Alter von 18 bis 89 Jahren (vollendete
Lebensjahre). Das mittlere Alter betrug 61.6 ± 12.3 Jahre, der Altersmedian war 64.2
Jahre mit einem 68%-CI von 48.6 bis 72.4 Jahren.
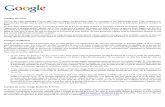
55 Patienten (37%) waren männlich und 95 (63%) weiblich (s. Abbildung 1).
Abbildung 1. Geschlechtsverteilung
Sektoren für Geschl(V228)= 1, 2,
55
männlich
95
weiblich
Anzahl der männlichen und weiblichen Patienten. n = 150.
Die Altersspanne ist sehr breit – sowohl bei den Männern als auch den Frauen.
Der jüngste männliche Patient war 18 Jahre, dies ist sehr außergewöhnlich. Er erkrankte
im Jahr 2009 an einem hepatozellulären Karzinom, woraufhin eine Lebertransplantation
folgte. Aufgrund multipler Metastasen in der Wirbelsäule und dem Wadenbeinköpfchen
sollte er mit Bisphosphonaten behandelt werden. Zur Voruntersuchung war er in der
Uni Erlangen vorstellig. Bis zum Studienende nahm er keinen Follow-up-Termin wahr.
Der Nächstjüngere war 37 Jahre alt und der älteste männliche Patient war 89 Jahre. Die
jüngste Patientin war 29 Jahre, die älteste 83 Jahre.

20
Abbildung 2. Alter und Geschlecht n %
0
2
4
6
8
10
12
14
16
18
0%
1%
2%
3%
4%
5%
6%
7%
8%
9%
10%
11%
12%
Anzahl %
Geschl(V228)= 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2
Alter(V227)< 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90
Alter 15-19 20-24 25-29 30-34 35-39 40-44 45-49 50-54 55-59 60-64 65-69 70-74 75-79 80-84 85-89
Jede Säule stellt Anzahl und Prozentsatz der Patienten in der genannten Altersgruppe (vollendete Lebens-
jahre) dar, aufgeteilt nach Geschlecht, = männlich, = weiblich. n= 150.
Die Altersgruppen wurden im Abstand von fünf Jahren gewählt.
Der Modus, welcher die maximale Anzahl in einer Gruppe beschreibt, liegt bei den
Frauen in der Altersgruppe 65 – 69, 19 Patientinnen umfasst diese Altersgruppe. Ein
zweiter Gipfel ist in der Gruppe bei den 50 bis 59-Jährigen zu verzeichnen. Es liegt
somit eine Bimodalität vor.
Bei den Männern verzeichnet man die größte Anzahl bei den 70 bis 74-Jährigen mit 18
Probanden. Einen zweiten, wenngleich auch nicht so markanten Gipfel, ist bei den 55
bis 59-Jährigen zu erkennen. Die Verteilung ist dementsprechend auch bimodal.
Tabelle 1. Geschlecht und Alter
Alter
Geschlecht n % MW ST Median 68%-CI pU
männlich 55 36.67 64.97 11.69 68.74 55.85 73.689 0.0035**
weiblich 95 63.33 59.59 12.23 60.44 47.125 71.228
gesamt 150 100.00 61.57 12.28 64.19 48.586 72.391 –
MW = Mittelwert, ST = Standardab -Test nach Mann und Whitney.

21
Die männlichen 55 Patienten wiesen ein Durchschnittsalter von 65 Jahren auf und
waren demzufolge im Schnitt um über 5 Jahre älter als die Patientinnen (siehe auch
Abb.2). Das Durchschnittsalter liegt bei 62 Jahren.
4.2 Risiken und allgemeine Erkrankungen
Tabelle 2. Risiken und Erkrankungen
Allgemeine Erkrankung n % 95%-CI
Allergien 53 35.33% 27.83% 43.60%
andere Allgemeinerkrankung 54 36.00% 28.45% 44.28%
Diabetes mellitus 21 14.00% 9.07% 20.83%
Herz-Kreislauf-Erkrankung 69 46.00% 37.91% 54.31%
Hypercholesterinämie 27 18.00% 12.39% 25.29%
Hyperurikämie 3 2.00% 0.41% 5.73%
Lebererkrankung 9 6.00% 2.78% 11.42%
Nierenerkrankung 19 12.67% 7.99% 19.32%
Nikotinabusus 11 7.33% 3.72% 13.06%
Rheumatische Erkrankung 9 6.00% 2.78% 11.42%
täglicher Alkoholkonsum 16 10.67% 6.41% 17.01%
Anzahl (n) und Prozentsatz der allgemeinen Erkrankungen bei 150 untersuchten Patienten. CI = Kon-
fidenzintervall (Unter- und Obergrenze)
Die aufgeführte Tabelle beschreibt alle Allgemeinerkrankungen, welche das
Patientenkollektiv aufwies. Fast die Hälfte aller Patienten (46%) litt unter Herz-
Kreislauf-Erkrankungen. Häufig (bei 35%) wurden auch Allergien, Hypercholesterinä-
mie (18%) und Diabetes (14%) angegeben.
Als mögliche Risiken wurden täglicher Alkoholkonsum, unabhängig von der Wahl und
Menge des Alkohols, und Nikotinabusus erfasst. Letztgenannter Risikofaktor wird in
der Regel in pack years definiert [57]. In dieser Studie wurde ein täglicher
Zigarettenkonsum ohne quantitative Limitierung als Nikotinabusus festgelegt.
Maligne Erkrankungen als Zusatzerkrankungen gab es nicht, alle malignen
Erkrankungen sind Grunderkrankungen.

22
Abbildung 3. Risiken und Erkrankungen n %
0
20
40
60
80
100
120
140
Anzahl %
0
5
10
15
20
2530
35
40
45
50
55
60
65
70
75
8085
90
95
100
Histogramme von Chol(V17),urik(V20),nikot(V21),Alkoh(V22),allerg(V24),HerzKr(V12),rheuma(V13),DM(V14),leberE(V15),niereE(V18),malign(V19),AllgEr(V23)
Abschnitte für Werte >= 1, 0,
Chol Urik Nik Alk All Herz Rh DM Leb Nier mal and
Die Säulen stellen Anzahl (n) und Prozentsatz der Erkrankungen der untersuchten 150 Patienten dar.
Chol = Hypercholesterinämie, Urik = Hyperurikämie, Nik = Nikotinabusus, Alk = tägli-
cher.Alkoholkonsum, All = Allergien, Herz = Herz-Kreislauferkrankungen, Rh = Rheumatische Erkran-
kungen, DM = Diabetes mellitus, Leb = Lebererkrankungen, Nier = Nierenerkrankungen, mal = maligne
Erkrankungen, and = andere Allgemeinerkrankungen
4.3 Grunderkrankung
Tabelle 3. Grunderkrankung, die zur Bisphosphonat-Therapie führte
Grunderkrankung n % 95%-CI
andere Grunderkrankungen 21 14.00% 9.07% 20.83%
Bronchial-Ca 11 7.33% 3.72% 13.06%
Lymphom 11 7.33% 3.72% 13.06%
Mamma-Ca 67 44.67% 36.62% 52.99%
Multiples Myelom 15 10.00% 5.71% 16.24%
Nieren-Ca 9 6.00% 2.78% 11.42%
Osteoporose 35 23.33% 16.99% 31.07%
Prostata-Ca 21 14.00% 9.07% 20.83%
Anzahl (n) und Prozentsatz der Grunderkrankungen der untersuchten 150 Patienten, CI = Konfidenzin-
tervall (Unter- und Obergrenze)

23
Die häufigste Grunderkrankung war das Mamma-Karzinom mit insgesamt 67
Patientinnen. Von diesen litten 19 noch zusätzlich an einer anderen Grunderkrankung.
Die einzige nichtmaligne Grunderkrankung, die mit Bisphosphonaten behandelt wurde,
war eine Osteoporose. Diese wurde bei 35 Patienten und somit am zweithäufigsten
therapiert. Das Prostata-Karzinom kam zu 14% vor. Bronchial-Karzinome und Lym-
phome führten bei je elf Patienten zur Bisphosphonat-Therapie.
Die Zeile “andere Grunderkrankungen” beschreibt maligne Erkrankungen, welche zu
ossären Metastasen führen können und somit prophylaktisch oder therapeutisch mit
Bisphophonaten therapiert werden. Diese Gruppe umfasst insgesamt 27 Patienten.
Aufgrund der geringen Fallzahl der einzelnen Grunderkrankungen (n<7) zentrieren wir
sie in einer Gruppe. In dieser Studie waren unter anderem das Schilddrüsenkarzinom
(n=4) und Pankreaskarzinom (n=1) vorzufinden.
Abbildung 4. Grunderkrankung
n %
0
20
40
60
80
100
120
140
Anzahl %
0
5
10
15
20
2530
35
40
45
50
55
60
65
70
75
8085
90
95
100
Histogramme von multmy(V3),mammca(V4),prosca(V5),nierca(V6),bronca(V7),lympho(V8),paget(V9),grunde(V10),osteop(V11)
Abschnitte für Werte >= 1, 0,
Grunderkr MMy MM Pr Ni Br Ly MPg and Ost Ca Ca Ca Ca
Die Säulen stellen Anzahl (n) und Prozentsatz der Grunderkrankungen aller untersuchten 150 Patienten
dar. MMy = Multiples Myelom, MM Ca = Mamma-Ca, Pr Ca = Prostata Ca, Ni Ca = Nierenzell-Ca, Br
Ca = Bronchial Ca, Ly = Lymphom, MPg = M. Paget, and = andere (maligne) Grunderkrankungen, Ost
= Osteoporose.

24
4.3.1 Demographie und Grunderkrankung
Ein multiples Myelom hatten 10 männliche (18%) und 5 weibliche Patienten (5%, p =
0.013*). Auch ein Bronchial-Ca trat häufiger bei den männlichen Patienten auf (8/55 =
15%) als bei den Patientinnen (3/95 = 3%, pfy = 0.019*). Die exakt gleiche Anzahl von
Erkrankungen gab es bei den Lymphomen/Leukämien.
Osteoporose hatten 7/55 (13%) der männlichen und 27/95 (28%) der weiblichen
Patienten. p = 0.047* im Chi-Quadrat-Test.
4.4 Medikamente
Tabelle 4. Medikamente
Medikamente n % 95%-CI
Analgetika 47 31.33% 24.15% 39.49%
Antidiabetika 13 8.67% 4.70% 14.66%
Antiepileptika 5 3.33% 1.09% 8.01%
Antihypertensiva 58 38.67% 30.94% 46.99%
Antikoagulantien 34 22.67% 16.41% 30.36%
Antirheumatika 7 4.67% 1.90% 9.75%
Diurektika 14 9.33% 5.20% 15.45%
Glukocortikoide 35 23.33% 16.99% 31.07%
Hormontherapie 70 46.67% 38.54% 54.96%
Lipidsenker 16 10.67% 6.41% 17.01%
Anzahl (n) und Prozentsatz der eingenommenen Medikamente der untersuchten 150 Patienten
Die oben aufgeführte Tabelle listet Medikamentengruppen auf, welche die Patienten
während einer Bisphosphonattherapie einnahmen und die möglicherweise auch mit
ihnen zusammen wirken. Zumeist kamen Hormontherapeutika zum Einsatz (n=70),
gefolgt von Antihypertensiva (n=58) und Analgetika (n=47). Glucokortikoide wurden
von 35 Patienten eingenommen.
Trotz 21 Patienten, welche angaben unter Diabetes zu leiden, nahmen nur 13 Antidiabe-
tika ein. Die Gesamtanzahl der Medikamente überstieg die Anzahl der Patienten
deutlich, da in den meisten Fällen multimedikamentös behandelt wurde.

25
4.5 Chemostatika, Zytostatika
Tabelle 5. Zytostase und Chemotherapie
n %
Chemotherapie ohne Zytostatika 63 42.00%
Zytostatika ohne Chemotherapie 4 2.67%
Chemotherapie und Zytostatika 6 4.00%
keins von beiden 77 51.33%
n = 150
Das Patientenkollektiv dieser Studie bestand aus 73 Patienten (49%) mit Zytostatika-
oder Chemotherapie und 77 Patienten (51%) ganz ohne Chemotherapie oder
Zytostatika. Vier Prozent der Probanden bekamen Chemotherapeutika und Zytostatika.
4.6 Bisphosphonat
In diesem Abschnitt werden die 114 Patienten mit begonnener BIS-Therapie
beschrieben.
Der Beobachtungszeitraum seit Beginn der BIS-Therapie von 114 Patienten mit
beobachteter Therapie lag zwischen 56 Tagen und 11.1 Jahren und betrug im Mittel
3.07 ± 2.48 Jahre. Der Median war 2.23 Jahre mit einem 68%-CI von 0.82 bis 5.69
Jahren.
Zwischen dem Ende der BIS-Therapie und dem Ende der Beobachtungszeit lagen 57
Tage bis 3.9 Jahre.
Tabelle 6. BIS-Medikationen
Zahl der BIS-Medikationen n %
0 geplant 36 24.00%
1 ein Präparat in einer Form mit einem Intervall 103 68.67%
2 einmal Präparatwechsel 10 6.67%
3 zweimal Medikamentwechsel 1 0.67%
Zahl der Patienten, die im Beobachtungszeitraum keine BIS-Medikation erhalten hatten (die Medikation
war erst geplant), die ein Präparat in einer Form und mit einem Intervall erhalten hatten, und die 2 oder
3 Präparate erhalten hatten (worin auch Änderungen der Darreichungsform oder Änderungen des Inter-
valls bei gleichem Präparat enthalten sind). n = 150 Patienten.

26
Von den 150 Patienten, waren 36 in der BIS-Sprechstunde vor der BIS-Therapie
vorstellig. Vor einer geplanten Therapie mit Bisphosphonaten muss der gesamte
Zahnhalteapparat saniert sein. Alle chirurgischen Maßnahmen wie zum Beispiel
Extraktionen, Wurzelspitzenresektionen, Parodontitisbehandlungen oder Implantat-
insertionen sollten idealerweise vor der Bisphosphonat-Therapie erfolgt sein, da die
oben genannten Maßnahmen in einem mit BIS angereicherten Knochen das Risiko eine
BONJ zu entwickeln, steigern.
Mehr als zwei Drittel (n=103) bekamen ein Präparat, zehn Patienten durchliefen einen,
ein Patient sogar zwei Präparatewechsel.
Tabelle 7. BIS-Medikation
BIS-Therapie n %
Therapie in der weiter durchgeführt 30 26.32 %
Beobachtungszeit beendet 84 73.68 %
Darreichungsform i.v. 103 91.96 %
oral 9 8.04 %
fehlende Angabe 2 –
Intervall wöchentlich 7 6.25 %
monatlich 74 66.07 %
monatlich, dann jährlich 7 6.25 %
jährlich 24 21.23 %
keine Angabe 2 –
Präparat Alendronat 5 4.39 %
Ibandronat 4 3.51 %
Pamidronat 8 7.02 %
Risedronat 2 1.75 %
Zoledronat 84 73.68 %
Zoledronat und Ibanddronat 6 5.26 %
Zoledronat und Pamidronat 1 0.88 %
Zoledronat und Risedronat 1 0.88 %
Pamidronat und Zoledronat 1 0.88 %
Clodronat und Zoledronat 1 0.88 %
Zoledronat, Pamidronat, Ibandronat 1 0.88 %
Art der Bisphosphonat-Medikation für 114 Patienten mit beobachteter BIS-Medikation. Anzahl und Pro-
zentsatz der Patienten.
Die Tabelle 7 beschreibt die einzelnen Parameter der Bisphosphonatmedikation.
Während der Studiendauer kam es bei 84 Patienten zum Beenden der regelmäßigen
Einnahme, nur 30 Patienten wurden auch nach dieser Studie weiterhin mit BIS
therapiert.

27
Die Applikation konnte oral oder intravenös erfolgen. Letzteres war am häufigsten
vertreten (92%).
Bisphosphonate werden in regelmäßigen Intervallen appliziert. Am seltensten wurden
wöchentliche bzw. monatliche mit Wechsel zur jährlichen Applikation (je n=7)
befundet. Zwei Drittel der Patienten bekamen monatlich Bisphosphonate verabreicht.
Mit fast drei Viertel (74%) aller Präparate ist Zolendronat das am häufigsten
verwendete. Pamidronat folgt mit 7%. Nur Einzelfälle wurden mit einer Kombination
aus zwei Präparaten therapiert.
Abbildung 5. Beobachtungszeit
0
5
10
15
20
25
0%
2%
4%
6%
8%
10%
12%
14%
16%
18%
20%
22%
Anzahl %
Beobachtungszeit < 1 2 3 4 5 6 7 8 9 10 11 12 Beobachtungszeit in Jahren für die Anzahl (n) der therapierten 114 Patienten mit beobachteter BIS-
Medikation.
Die Beobachtungszeit beschreibt die Zeitspanne, beginnend vom Zeitpunkt, zu dem der
Patient mit der Bisphosphonattherapie begonnen hat, bis zur letzten Vorstellung in der
BIS-Sprechstunde (zuletzt dokumentiertes Follow-up während der epidemiologischen
Studie).

28
Die Therapiedauer definiert sich vom Beginn der BIS-Therapie bis zum Absetzen der
Bisphosphonate.
Bei 8 der 19 Patienten mit Therapieänderung (6 mal Zoledronat, 1 mal Alendronat, 1
mal Pamidronat) wurde nur das Intervall auf 1 Jahr geändert, bzw. hatte einer der
Patienten eine Lücke von 5 Jahren in der Medikament-Einnahme.
Bei 9 weiteren Patienten wurde eine Zoledronat-Therapie umgestellt auf Ibandronat (6
mal), Risedronat, Pamidronat (je einmal) und ein Patient erhielt nach Zoledronat
zunächst Pamidronat, dann Ibandronat.
Bei zwei weiteren Patienten wurde umgekehrt von Clodronat bzw. Pamidronat
umgestellt auf Zoledronat, ohne Änderung von Intervall oder Darreichungsform.
4.6.1 Alter, Geschlecht und Bisphosphonat
Tabelle 8. Alter und Bisphosphonat-Therapie
n MW ST p
Alter [Jahre]
Präparat Alendronat 5 71.54 10.97
Ibandronat 4 68.41 3.94
Pamidronat 8 64.01 14.30
Risedronat 2 76.80 2.09
Zoledronat 84 59.92 11.85
mehrere Präparate 11 62.44 7.28 0.0190 *
Darreichungsform i.v. 103 60.70 11.77
oral 9 71.08 8.19 0.0069 **
keine Angaben 2 - -
Intervall wöchentlich 7 69.90 11.70
monatlich 74 63.34 10.35
monatlich, dann jährl. 7 59.57 12.81
jährlich 24 53.77 12.68 0.0020 **
keine Angaben 2 - -
MW = Mittelwert, ST = Standardabweichung, p aus dem U-Test nach Mann und Whitney. n = 114 Pati-
enten mit beobachteter BIS-Medikation.
Die Tabelle 8 beschreibt den direkten Zusammenhang zwischen dem Alter und der
Bisphosphonattherapie, welcher durch die Signifikanzen sowohl in den Präparat-
gruppen, beiden Darreichungsmöglichkeiten, als auch in den Intervallen aufgezeigt
wird.

29
Die Altersgruppen sind je nach Präparat verschieden. Den meisten Patienten wurde
Zolendronat verabreicht (n=84). Sie waren zudem auch mit einem Mittelwert von 60
Jahren die Jüngsten, im Gegensatz zu den Patienten, welche andere Präparate bekamen.
Mit Risedronat wurden vor allem ältere Patienten (MW=77 Jahre) therapiert.
Bei der Mehrheit (n=103) wurden die Bisphosphonate intravenös appliziert, nur 9
Patienten nahmen sie in Tablettenform ein. Die oral Therapierten waren zudem circa
zehn Jahre älter.
Fast ein Fünftel aller Patienten bekam die Bisphosphonattherapie im jährlichen
Intervall. Die Gruppe war mit durchschnittlich 54 Jahren auch die jüngste.
Weitaus häufiger (n=74) wurde monatlich appliziert.
Ältere Patienten (im Durchschnitt 70 Jahre alt) wurden wöchentlich mit
Bisphosphonaten therapiert.
Tabelle 9. Geschlecht und BIS-Intervall
Geschlecht
männlich weiblich
n % n % p
Intervall wöchentlich 1 2.86% 6 7.79%
monatlich 33 94.29% 41 53.25%
monatlich, dann jährl. 0 0.00% 7 9.09%
jährlich 1 2.86% 23 29.87% 0.000035***
Die Prozente beziehen sich auf die Spalte, d.h. auf das Geschlecht. p aus dem Chi-Quadrat-Test . für 112
Patienten mit beobachteter BIS-Medikation, da von den 114 Patienten 2 keine Angaben zum Intervall
geben konnten
Ein hoch signifikanter Zusammenhang (p=0,000035) zwischen den Geschlechtern und
dem gewählten Intervall der BIS-Medikation wird in Tabelle neun ersichtlich.
Männer bekamen mit 94% fast ausschließlich Bisphosphonate monatlich verabreicht.
Bei den Frauen wird ebenfalls am häufigsten (53%) monatlich appliziert. Wöchentliche
Bisphosphonatgaben und der Wechsel von monatlicher auf eine jährliche Applikation
waren für insgesamt je sieben Probanden und somit die seltenste Therapieform der
Wahl.
Auffällig sind allerdings die 30% aller Patientinnen mit jährlichem Intervall. Bei den
männlichen Patienten wählte man nur in 3% der Fälle diese Zeitspanne.

30
Abbildung 6. Geschlecht und BIS-Intervall
Anzahl Patienten
männlich weiblich
Intervall Woche Monat Monat, dann Jahr Jahr
133 16
41
7 23
1
Zahl der männlichen und weiblichen Patienten, eingeteilt nach dem Intervall der BIS-Gabe. n = 112
Patienten mit BIS- Medikation im Beobachtungszeitraum, da von den 114 Patienten 2 keine Angaben zum
Intervall geben konnten
Diese Abbildung verdeutlicht die Unterschiede der Intervalle je Geschlecht.
Die Männer (linkes Kreisdiagramm) wurden fast ausschließlich monatlich mit
Bisphosphonaten therapiert, nur ein kleiner Prozentsatz bekam wöchentlich oder
jährlich BIS intravenös oder oral verabreicht. Wechsel vom monatlichen zum jährlichen
Intervall kamen bei den männlichen Studienteilnehmern nicht vor.
Bei den Frauen (rechtes Kreisdiagramm) wurden mehr als die Hälfte monatlich mit
Bisphosphonaten therapiert. Das jährliche Intervall kam in fast 30% der Fälle zum
Einsatz. Wöchentliche Applikationen und ein Wechsel vom monatlichen zum jährlichen
Intervall fanden fast gleich selten (n=6 bzw. n=7) statt.

31
4.6.2 Grunderkrankung und Bisphosphonat
Die Osteoporosepatienten unterschieden sich in der BIS-Therapie von den Patienten mit
malignen Erkrankungen.
Tabelle 10. Osteoporose und BIS-Therapie
Osteoporose
ja nein
n % n % p
Präparat Alendronat 5 16.67% 0 0.00%
Ibandronat 3 10.00% 1 1.19%
Pamidronat 2 6.67% 6 7.14%
Risedronat 2 6.67% 0 0.00%
Zoledronat 16 53.33% 68 80.95%
mehrere 2 6.67% 9 10.71% 0.000062***mp
Darreichungsform i.v. 22 75.86% 81 97.59%
oral 7 24.14% 2 2.41% 0.0010**fy
keine Angaben 1 – 1 –
Intervall wöchentlich 6 20.69% 1 1.20%
monatlich 13 44.83% 61 73.49%
monatl. dann jährl. 3 10.34% 4 4.82%
jährlich 7 24.14% 17 20.48% 0.0018**c
keine Angaben 1 – 1 –
Die Prozente beziehen sich auf die Spalte, d.h. auf Osteoporose. p aus dem exakten Test nach Mehta und
Patel (mp) bzw. nach Fisher und Yates (fy), Chi-Quadrat-Test (c). für 114 Patienten mit beobachteter
BIS-Medikation
Sowohl bei den malignen Grunderkrankungen (81%) als auch bei Osteoporose (53%)
war Zoledronat das Therapiemittel der Wahl. Risedronat (7%) und Alendronat (17%)
wurden auffälligerweise nur bei den Osteoporosepatienten appliziert.
Ebenso die orale Darreichungsform wurde bei den Osteoporosepatienten signifikant
häufiger (24%) als bei den Patienten mit malignen Erkrankungen (2%) gewählt.
Das monatliche Intervall war in beiden Gruppen am stärksten vertreten, prozentual bei
den malignen Grunderkrankungen signifikant höher (74%) als bei den
Osteoporosepatienten (45%). An Osteoporose Erkrankte applizierte man
vergleichsweise häufig (21%) wöchentlich Bisphosphonate, nur 1% der malignen
Grunderkrankungen wurde in diesem Intervall therapiert.

32
Tabelle 11. Intervall und Grunderkrankung
Intervall
Woche Monat Mon./ Jahr Jahr
(n1 = 7) (n1 = 74) (n1 = 7) (n1 = 24)
n2 % n2 % n2 % n2 %
Andere Grunderkr. 0 0.0% 10 13.5% 1 14.3% 1 4.2%
Bronchial-Ca 0 0.0% 8 10.8% 0 0.0% 0 0.0%
Lymphom/L 0 0.0% 4 5.4% 1 14.3% 0 0.0%
Mamma-Ca*** 0 0.0% 31 41.9% 4 57.1% 21 87.5%
mult.Myelom 1 14.3% 11 14.9% 0 0.0% 1 4.2%
Nieren-Ca 0 0.0% 2 2.7% 0 0.0% 0 0.0%
Osteoporose** 6 85.7% 13 17.6% 3 42.9% 7 29.2%
Prostata-Ca 0 0.0% 14 18.9% 0 0.0% 1 4.2%
Prozente Spaltenweise lesen. Es gab Patienten mit mehreren Grunderkrankungen.
Sterne = signifikant, kein Stern n.s., Mon./ Jahr = Wechsel vom monatl. zum jährl. In-
tervall
Diese Tabelle zeigt auf, welche Grunderkrankung typischerweise in welchem Intervall
therapiert wurde. Von den 114 mit Bisphosphonaten tatsächlich therapierten Patienten
konnten zwei keine Angabe zu dem Intervall machen – dementsprechend ist die
Gesamtzahl der Patienten 112 (Summe aus n1). Hinzu kommt, dass einige Patienten an
mehreren Grunderkrankungen litten. Dies hat zur Folge, dass n2 n1 übersteigt.
Das wöchentliche Intervall und der Wechsel vom monatlichen zum jährlichen Intervall
war mit je nur sieben Patienten am seltensten. Die BIS-Applikation mit Intervallände-
rung von monatlich auf jährlich bestand zu 57% aus Mammakarzinom-Patienten (n=4)
und 43% Osteoporosepatienten (n=3). Im wöchentlichen Intervall wurden zumeist (n=6,
86%) von den Osteoporosepatienten therapiert Ein Patient mit multiplem Myelom wur-
de ebenfalls in diesem Intervall mit Bisphosphonaten versorgt (n=1, 14%).
Am häufigsten wurden Bisphosphonate monatlich appliziert (n=74). Mit 42% betraf
dies am meisten die Brustkrebspatientinnen, gefolgt von den Prostatakarzinom- (19%)
und den Osteoporosepatienten (18%).
Das jährliche Intervall wurde 24 mal befundet. Auffällig und hochsignifikant dabei ist,
dass fast alle (n=21) in diesem Intervall therapierten Patienten ein Mammakarzinom als
Grunderkrankung aufwiesen.
An Nieren- und Bronchialkarzinomen leidende Patienten wurden ausschließlich im
monatlichem Intervall behandelt.

33
Tabelle 12. Chemotherapie und Einnahmeform der BIS
Chemotherapie
ja nein
n % n % p
Zahl Medikam. keine 15 20.55% 21 27.27%
(n = 150) eins 53 72.60% 50 64.94%
2-3 5 6.85% 6 7.79% 0.58
Ende von BIS vor last seen 11 18.97% 19 33.93%
bei last seen 47 81.03% 37 66.07% 0.069
Darreichung i.v. 57 98.28% 46 85.19%
oral 1 1.72% 8 14.81% 0.014*fy
Intervall wöchentlich 1 1.72% 6 11.11%
monatlich 40 68.97% 34 62.96%
mo,dann jährl. 6 10.34% 1 1.85%
jährlich 11 18.97% 13 24.07% 0.038*
Präparat Alendronat 0 0.00% 5 8.93%
Ibandronat 0 0.00% 4 7.14%
Pamidronat 4 6.90% 4 7.14%
Risedronat 1 1.72% 1 1.79%
Zoledronat 48 82.76% 36 64.29%
mehrere 5 8.62% 6 10.71% 0.034*mp
Chemotherapie = Chemotherapeutika und Zytostatika. n = 150 für den ersten Abschnitt und n = 114
Patienten mit Medikation für die folgenden, wobei 2 Patienten keine Angaben zur Darreichung und zum
Intervall machen konnten n = 112.
Tabelle 12 beschäftigt sich mit der möglichen Wechselwirkung zwischen BIS und
Chemotherapie. In dieser Studienreihe mussten sich 77 der Patienten keiner
Chemotherapie unterziehen. Die meisten Patienten wurden mit nur einem
Bisphosphonat (65%) therapiert, nur 8% bekamen mehrere und 27% noch keine
Bisphosphonate.
In der Chemotherapiegruppe (n=73) war die Verteilung ähnlich, 73% bekamen ein
Bisphosphonat, 7% mehrere und 21% noch keine.
Insgesamt nahmen 150 Patienten an der Studie teil, wovon 114 mit Bisphosphonaten
therapiert wurden (36 wurden vor einer ersten Therapie befundet).
84 Patienten beendeten die Bisphosphonattherapie vor Studienende (“bei last seen”),
wovon 47 der Gruppe mit zusätzlicher Chemotherapie entstammen.
30 Studienteilnehmer wurden auch noch nach Studienende mit Bisphosphonaten
therapiert (“nach last seen”), der Großteil (n=19) geht aus der Gruppe ohne zusätzliche
Chemotherapie hervor.

34
Patienten dieser epidemiologischen Studie, welchen zusätzlich Chemotherapeutika ver-
abreicht wurden, bekamen zu 98% die BIS intravenös appliziert und somit nur 2% oral.
Bei der chemotherapeutikafreien Gruppe wurde das Bisphosphonat zu 14% oral
verabreicht.
Sowohl die Chemotherapie- (69%) als auch die chemotherapiefreie Gruppe (63%)
wurden zumeist monatlich mit Bisphosphonaten therapiert. Im monatlichen mit Wech-
sel zum jährlichen Intervall wurde bei der nicht Chemotherapie-Gruppe nur ein Patient
behandelt (2%), bei den Patienten unter zusätzlicher Chemotherapie waren es 10%
(n=6).
Unterschiede verzeichnete man auch in der Präparatewahl: Pamidronat und Risedronat
kamen in beiden Gruppen bei gleich vielen Patienten zum Einsatz, wohingegen
Alendronat und Ibandronat nur in der chemotherapiefreien Gruppe eingesetzt wurden.
Am häufigsten wurde Zolendronat sowohl in der Chemotherapie- (83%) als auch in der
chemotherapiefreien Gruppe (64%) verabreicht.

35
4.7 Nekrosefreiheitsrate
Abbildung 7. Nekrosefreiheit Nekrosefreiheitsrate [%]
0
10
20
30
40
50
60
70
80
90
100
0 1 2 3 4 5 6 7 8 9 10 11
Zeit
Überlebensrate
Überlebensrate mit Streubereich
Zeit: (V1085), (V1086), (V1087) BIS EDTag(V1051), EDMon(V1052), EDJhr(V1053
Ereignis (T): bakn(V165)= 1 Censored (L): bakn(V165)= 0
Zeit seit Beginn der BIS-Therapie [Jahre]
Prozentsatz der Patienten, die zu einem Zeitpunkt, der auf der x-Achse abzulesen ist, noch keine BIS-
Nekrose hatten. n = 114 Patienten mit BIS-Therapie. Die mittlere gepunktete Linie ist die Nekrosefrei-
heitsrate, die beiden äußeren Linien begrenzen deren 95%-Vertrauensbereich nach oben und unten. Die
Strichlein markieren Patienten, deren Therapiedauer über die Beobachtungszeit hinausging. Berechnung
nach Kaplan und Meier.
Tabelle 13. Nekrosefreiheitsrate
Zeit [Jahre] in Beobachtung Nekrosefreiheitsrate [%] Untergrenze Obergrenze
0 114 100.0 - -
1 89 97.0 95.3 98.7
2 58 87.1 83.2 91.0
3 40 80.2 75.3 85.1
4 30 75.9 70.4 81.4
5 17 58.7 51.2 66.2
6 13 55.2 47.4 63.1
7 8 44.6 35.4 53.9
8 3 37.2 26.9 47.5
9 2 24.8 12.6 37.0
Prozentsatz der zu den genannten Zeiten noch nekrosefreien Patienten. Zusätzlich sind Unter- und Ober-
grenze dieser Prozentsätze aus der Standardabweichung angegeben.
Die Beobachtungszeit ist definiert als die Zeit zwischen BIS-Beginn und BIS-Ende. Sie
lag zwischen 0.153 Jahren und 11.126 Jahren.

36
Insgesamt bekamen 114 Patienten während der Beobachtungszeit Bisphosphonate
verabreicht. Im Beobachtungsjahr null lag die Nekrosefreiheitsrate bei 100%. Ein Jahr
später wurden noch 89 Patienten untersucht, wovon 97% keine Nekrose aufwiesen.
Im Beobachtungsjahr fünf bestand das Patientenkollektiv aus 17 Personen. Die Schät-
zung nach Kaplan-Meier ergibt 59% ohne Nekrose.
Zwei Patienten standen unter der längsten Beobachtungszeit dieser Studie. Nach 9 Jah-
ren waren gemäß der Schätzung nach Kaplan-Meier noch 25% aller Patienten ohne
Nekrose.
4.7.1 Alter, Geschlecht und Nekrosefreiheitsrate
Abbildung 8. Alter und Nekrose Nekrosefreiheitsrate [%]
0
10
20
30
40
50
60
70
80
90
100
0 1 2 3 4 5 6 7 8 9 10 11
Zeit
Überlebensrate
Alter(V227) Alter(V227)<6565<=Alter(V227)<99
Überlebensrate
Zeit: (V1085), (V1086), (V1087) BIS EDTag(V1051), EDMon(V1052), EDJhr(V1053
Ereignis (T): bakn(V165)= 1 Censored (L): bakn(V165)= 0
Zeit seit Beginn der BIS-Therapie [Jahre]
Prozentsatz der zum jeweiligen Zeitpunkt, der auf der x-Achse abzulesen ist, noch nekrosefrei beobachte-
ten Patienten, differenziert nach Alter: ——— = 18 bis 64 Jahre, - - - - - = 65 bis 89 Jahre.

37
Tabelle 14. Alter und Nekrosefreiheitsrate seit Beginn der BIS-Therapie
Alter
Gesamt 18 bis 64 Jahre = A 65-89 Jahre = B
n = 114 n = 61 n = 53
Zeit [Jahre] Anzahl Anzahl NFR Anzahl NFR
0 114 61 100.00 53 100.00
1 89 43 95.83 46 98.04
2 58 27 89.22 31 85.28
3 40 17 89.22 23 73.75
4 30 13 89.22 17 66.72
5 17 8 81.79 9 44.23
6 13 6 81.79 7 39.32
7 8 3 65.43 5 32.77
8 3 0 32.71 3 32.77
9 2 0 32.71 2 21.84
Prozentsatz der zu den genannten Zeiten noch nekrosefrei beobachteten Patienten, aufgeteilt nach Alter.
p = 0.065 im Log-Rank-Test. NFR= Nekrosefreiheitsrate
In diesen Darstellungen wird das Alter in Beziehung zur Nekrosefreiheit gesetzt. Dafür
wurden zwei Altersgruppen definiert: die Gruppe der 18 bis 64-Jährigen, im Weiteren
als Gruppe A festgelegt und die Gruppe der 65 bis 89-Jährigen, als Gruppe B definiert.
Im Beobachtungsjahr eins waren von den Patienten aus Gruppe B 98% und somit mehr
als zwei Prozentpunkte im Vergleich zur Gruppe A nekrosefrei. In allen darauf
folgenden Beobachtungsjahren war die Nekrosefreiheitsrate der jüngeren Gruppe immer
höher als die der älteren Gruppe. Im Beobachtungsjahr sechs ist der Unterschied am
deutlichsten. Beide Gruppen bestehen aus annähernd gleicher Patientenanzahl (Gruppe
A: n=6, Gruppe B: n=7), doch die Nekrosefreiheitsrate liegt in Gruppe A bei 82% und
demzufolge mehr als doppelt so hoch wie in Gruppe B (NFR=39%).

38
Abbildung 9. Geschlecht und Nekrose Nekrosefreiheitsrate [%]
0
10
20
30
40
50
60
70
80
90
100
0 1 2 3 4 5 6 7 8 9 10 11
Zeit
Überlebensrate
Geschl(V228) Geschl(V228)=1Geschl(V228)=2
Überlebensrate
Zeit: (V1085), (V1086), (V1087) BIS EDTag(V1051), EDMon(V1052), EDJhr(V1053
Ereignis (T): bakn(V165)= 1 Censored (L): bakn(V165)= 0
Zeit seit Beginn der BIS-Therapie [Jahre]
Prozentsatz der zum jeweiligen Zeitpunkt, der auf der x-Achse abzulesen ist, noch nekrosefrei beobachte-
ten Patienten, differenziert nach Geschlecht:. ——— = männlich, - - - - - = weiblich.
Tabelle 15. Geschlecht und Nekrosefreiheitsrate seit Beginn der BIS-Therapie
Geschlecht
Gesamt männlich weiblich
n = 114 n = 37 n = 77
Zeit [Jahre] Anzahl Anzahl NFR Anzahl NFR
0 114 37 100.00 77 100.00
1 89 30 94.20 59 98.44
2 58 18 74.50 40 94.00
3 40 11 60.68 29 91.16
4 30 10 60.68 20 84.40
5 17 7 42.48 10 68.44
6 13 5 42.48 8 61.60
7 8 4 42.48 4 42.24
8 3 3 31.86 0 42.24
9 2 2 21.24 0 42.24
Prozentsatz der zu den genannten Zeiten noch nekrosefrei beobachteten Patienten, aufgeteilt nach Ge-
schlecht, p = 0.046* im Log-Rank-Test. NFR = Nekrosefreiheitsrate
In der Studie wurden insgesamt 37 Männer und 77 Frauen, welche mit Bisphosphonaten
therapiert wurden, in regelmäßig empfohlenen Intervallen untersucht. Zwei Patienten
wurden über neun Jahre begleitet.

39
Im dritten Untersuchungsjahr waren noch 91% der Frauen (n=29) nekrosefrei,
wohingegen nur 61% der Männer keine Nekrose aufwiesen.
Nach einer Untersuchungszeit von fünf Jahren hatten 68% aller Patientinnen keine
BONJ entwickelt – bei den Männern waren es 42%.
Nach Abschluss der Studie galten 21% der Männer als nekrosefrei, bei den Frauen ist
der Wert doppelt so groß.
4.7.2 Zytostatika und Nekrose
Abbildung 10. Zytostatika und Nekrose Nekrosefreiheitsrate [%]
0
10
20
30
40
50
60
70
80
90
100
0 1 2 3 4 5 6 7 8 9 10 11
Zeit
Überlebensrate
zytost(V44) zytost(V44)=0zytost(V44)=1
Überlebensrate
Zeit: (V1085), (V1086), (V1087) BIS EDTag(V1051), EDMon(V1052), EDJhr(V1053
Ereignis (T): bakn(V165)= 1 Censored (L): bakn(V165)= 0
Zeit seit Beginn der BIS-Therapie [Jahre]
Prozentsatz der zum jeweiligen Zeitpunkt, der auf der x-Achse abzulesen ist, noch nekrosefrei beobachte-
ten Patienten, differenziert nach Zytostatika-Therapie. ——— = nein, - - - - - = ja.

40
Tabelle 16. Zytostatika und Nekrosefreiheitsrate seit Beginn der BIS-Therapie
Zytostatika
Gesamt nein ja
n = 114 n = 107 n = 7
Zeit [Jahre] Anzahl Anzahl NFR Anzahl NFR
0 114 107 100.00 7 100.00
1 89 85 97.84 4 83.33
2 58 55 88.80 3 62.50
3 40 39 84.97 1 20.83
4 30 29 80.25 1 20.83
5 17 16 61.35 1 20.83
6 13 12 57.52 1 20.83
7 8 8 51.13 0 0.00
8 3 3 42.61 0 0.00
9 2 2 28.41 0 0.00
Prozentsatz der zu den genannten Zeiten noch nekrosefrei beobachteten Patienten, aufgeteilt nach Bron-
chial-Ca als Grunderkrankung, p = 0.00029*** im Log-Rank-Test. NFR= Nekrosefreiheitsrate
Diese Darstellungen widmen sich dem Zusammenhang zwischen der Bisphosphonat-
und gleichzeitiger Zytostatikatherapie und der Entstehung einer BIS-Nekrose. Von den
114 unter Bisphosphonattherapie stehenden Patienten, nahmen sieben zusätzlich
Zytostatika ein. Bereits nach zwei Jahren sank die Nekrosefreiheitsrate auf 62,5%. Die
Gruppe, welche nicht zusätzlich mit Zytostatika behandelt wurde, wies eine im
Vergleich dazu erheblich höhere Nekrosefreiheitsrate auf (89%).
Im dritten Beobachtungsjahr war die Differenz eminent. Die Zytostatikagruppe bestand
nur noch aus einem Patienten. Die Nekrosefreiheitsrate war ein Viertel (21%) von der,
der Nichtzytostatikgruppe (85%). Diese Gruppe bestand zum selben Zeitpunkt noch aus
29 Patienten.
Eine zeitgleiche Zytostatikatherapie mit bestehender Bisphosphonatbehandlung führt zu
einem merklichen Sinken der Nekrosefreiheitsrate.

41
4.7.3 Bisphosphonat-Therapie und Nekrose
Abbildung 11. BIS-Präparate und Nekrose Nekrosefreiheitsrate [%]
0
10
20
30
40
50
60
70
80
90
100
0 1 2 3 4 5 6 7 8 9 10 11
Zeit
Überlebensrate
(V1081) (V1081)<=11<(V1081)<=22<(V1081)<=33<(V1081)<=44<(V1081)<=55<(V1081)<=999
Überlebensrate
Zeit: (V1085), (V1086), (V1087) BIS EDTag(V1051), EDMon(V1052), EDJhr(V1053
Ereignis (T): bakn(V165)= 1 Censored (L): bakn(V165)= 0
Zeit seit Beginn der BIS-Therapie [Jahre]
Prozentsatz der zum jeweiligen Zeitpunkt, der auf der x-Achse abzulesen ist, noch nekrosefrei beobachte-
ten Patienten, differenziert nach BIS-Präparat: ——— = Alendronat, - - - - - = Ibandronat, − ∙ − ∙ − ∙
− = Pamidronat, – – – – – = Risedronat. − ∙∙ − ∙∙ − ∙∙ − = Zoledronat. — − — − — − = mehrere Prä-
parate.
Tabelle 17. BIS-Präparat und Nekrosefreiheitsrate seit Beginn der BIS-Therapie
BIS-Präparat
Alle Alendronat Ibandronat Pamidronat Risedronat Zoledronat mehrere
114 (n = 5) (n = 4) (n = 8) (n = 2) (n = 84) (n = 11)
Zeit n n % n % n % n % n % n %
0 114 5 100.00 4 100.00 8 100.00 2 100.00 84 100.00 11 100.00
1 89 5 100.00 4 100.00 8 100.00 2 100.00 60 95.74 10 100.00
2 58 4 100.00 3 100.00 5 83.33 1 50.00 38 88.90 7 78.75
3 40 3 100.00 3 100.00 3 62.50 0 0.00 25 83.82 6 78.75
4 30 2 66.67 1 100.00 3 62.50 0 0.00 19 80.18 5 78.75
5 17 1 33.33 0 0.00 2 62.50 0 0.00 10 65.01 4 63.00
6 13 1 33.33 0 0.00 1 31.25 0 0.00 7 65.01 4 63.00
7 8 1 33.33 0 0.00 0 31.25 0 0.00 4 52.01 3 47.25
8 3 1 33.33 0 0.00 0 31.25 0 0.00 1 26.01 1 47.25
9 2 0 0.00 0 0.00 0 31.25 0 0.00 1 26.01 1 47.25
Zeit in Jahren seit Beginn der BIS-Therapie

42
Tabelle 17 zeigt die NFR nach jahrelanger BIS-Therapie mit den verschiedenen
Präparaten auf. Insgesamt wurden 114 Patienten mit Bisphosphonaten therapiert. Am
häufigsten (n=84) geschah die mit dem Präparat Zoledronat. Alle damit behandelten
Patienten wiesen nach fünfjähriger Therapie eine durchschnittliche NFR von 65% auf –
dies ist im Vergleich zu allen anderen eingesetzten Präparaten dieser Studie die höchste
Nekrosefreiheitsrate nach dieser Zeitspanne. Patienten, welche einen oder mehrere
Präparatwechsel durchmachten (n=11) hatten einen fast genauso hohen NFR-Wert
(63%). Das nächsthäufigste Präparat war Pamidronat (n=8). Es wies nach fünf Jahren
Therapie eine NFR von 62,5% auf und liegt somit knapp unter den vorher genannten
Präparaten. Unter der Therapie mit Ibandronat entwickelte kein Patient eine BONJ
(NFR=100% nach vier Jahren). Risedronat wurde nur zwei Patienten appliziert. Bereits
im zweiten Beobachtungsjahr halbierte sich die NFR.
Abbildung 12. BIS-Darreichungsform und Nekrose Nekrosefreiheitsrate [%]
0
10
20
30
40
50
60
70
80
90
100
0 1 2 3 4 5 6 7 8 9 10 11
Zeit
Überlebensrate
(V1083) (V1083)=15(V1083)=16
Überlebensrate
Zeit: (V1085), (V1086), (V1087) BIS EDTag(V1051), EDMon(V1052), EDJhr(V1053
Ereignis (T): bakn(V165)= 1 Censored (L): bakn(V165)= 0
Zeit seit Beginn der BIS-Therapie [Jahre]
Prozentsatz der zum jeweiligen Zeitpunkt, der auf der x-Achse abzulesen ist, noch nekrosefrei beobachte-
ten Patienten, differenziert nach Darreichungsform. ——— = i.v., - - - - - = oral.

43
Tabelle 18. BIS-Darreichungsform und Nekrosefreiheitsrate seit Beginn der BIS-Therapie
BIS-Darreichungsform
Gesamt i.v. oral
n = 112 n = 103 n = 9
Zeit [Jahre] Anzahl Anzahl NFR Anzahl NFR
0 112 103 100.00 9 100.00
1 87 78 96.61 9 100.00
2 58 52 88.22 6 85.71
3 40 35 80.42 5 85.71
4 30 27 77.98 3 64.29
5 17 15 61.48 2 42.86
6 13 12 61.48 1 21.43
7 8 7 48.42 1 21.43
8 3 2 38.73 1 21.43
9 2 2 38.73 0 0.00
Prozentsatz der zu den genannten Zeiten noch nekrosefrei beobachteten Patienten, aufgeteilt nach Dar-
reichungsform, p = 0.22 im Log-Rank-Test. NFR= Nekrosefreiheitsrate
Diese Tabelle vergleicht die NFR-Werte zwischen Patienten, welche intravenös
beziehungsweise oral mit BIS therapiert wurden. Die deutliche Mehrheit von 103
Studienteilnehmern unterlag einer intravenösen Applikation. Lediglich neun Probanden
nahmen die Bisphosphonate oral ein. Im Vergleich waren nach 5 Jahren
Beobachtungszeit Patienten, welche intravenös BIS verabreicht bekamen, seltener an
einer BONJ erkrankt (61,5% nekrosefrei) als bei den oral therapierten Patienten
(NFR=43%). Nach acht Jahren der Therapie wies die Gruppe der intravenös
behandelten Patienten eine Nekrosefreiheitsrate von 39% auf, die oral Therapierten
nach gleicher Therapiedauer eine von knapp 21,5%. Daraus lässt sich schlussfolgern,
dass oral Therapierte nach unseren Ergebnissen häufiger eine BONJ entwickeln, als
Patienten mit intravenöser Applikation.

44
Abbildung 13. BIS-Intervalle und Nekrose Nekrosefreiheitsrate [%]
0
10
20
30
40
50
60
70
80
90
100
0 1 2 3 4 5 6 7 8 9 10 11
Zeit
Überlebensrate
(V1084) (V1084)=11(V1084)=12(V1084)=16(V1084)=17
Überlebensrate
Zeit: (V1085), (V1086), (V1087) BIS EDTag(V1051), EDMon(V1052), EDJhr(V1053
Ereignis (T): bakn(V165)= 1 Censored (L): bakn(V165)= 0
Zeit seit Beginn der BIS-Therapie [Jahre]
Prozentsatz der zum jeweiligen Zeitpunkt, der auf der x-Achse abzulesen ist, noch nekrosefrei beobachte-
ten Patienten, differenziert nach Intervall. ——— = wöchentlich, - - - - - = monatlich, − ∙ − ∙ − ∙ − =
erst monatlich, dann jährlich, – – – – – = jährlich..
Tabelle 19. BIS-Intervall und Nekrosefreiheitsrate seit Beginn der BIS-Therapie
BIS-Darreichungsform
Gesamt kürzer als jährlich = A Jährlich = B
n = 112 n = 88 n = 24
Zeit [Jahre] Anzahl Anzahl NFR Anzahl NFR
0 112 88 100.00 24 100.00
1 87 70 96.13 17 100.00
2 58 49 87.47 9 100.00
3 40 35 79.42 5 100.00
4 30 26 74.60 4 100.00
5 17 14 55.06 3 100.00
6 13 11 51.12 2 100.00
7 8 7 39.76 1 100.00
8 3 3 33.14 0 100.00
9 2 2 22.09 0 100.00
Prozentsatz der zu den genannten Zeiten noch nekrosefrei beobachteten Patienten, aufgeteilt nach Dar-
reichungsform, p = 0.043* im Log-Rank-Test. NFR= Nekrosefreiheitsrate
Die Beziehung zwischen dem Applikationsintervall und der Entwicklung einer Nekrose
wird in diesen Diagrammen charakterisiert. Es wird von einer Gesamtzahl von 112

45
Patienten ausgegangen, da von den 114 Bisphosphonatpatienten zwei keine Angabe
zum Intervall geben konnten.
Es erfolgte eine Einteilung in zwei Gruppen: Gruppe A umfasst 88 Patienten, welche
ein kürzeres Intervall als jährliche BIS-Applikation aufweisen, Gruppe B, bestehend aus
24 Patienten wurden im jährlichen Intervall therapiert.
Gruppe B wies bis zum Ende der Beobachtungszeit keine Nekrosen auf.
Die Patienten, welche in kürzeren Abständen Bisphosphonate verabreicht bekamen,
verzeichneten im vierten Beobachtungsjahr eine Nekrosefreiheitsrate von 75%, im
darauf folgenden Jahr lag sie bei 55%.
Im Durchschnitt war die NFR bei den Patienten mit wöchentlicher Applikation am
niedrigsten und bei jährlicher Applikation am höchsten.
4.7.4 Multivariate Nekrosefreiheit
Die multivariate Statistik nach Cox wird für die 114 Patienten berechnet, die eine BIS-
Medikation erhalten hatten. Der erste Schritt erfolgt mit zehn Prediktoren. Das Nieren-
karzinom muss ausgeschlossen werden, da damit keine Konvergenz möglich war.
Tabelle 20. Multivariate Statistik nach Cox
Prediktor n β Str(β) HR 68%-CI von HR p(chi)
alle 10 Prediktoren, p= 0.0062 **
Alter 114 0.003 0.028 1.003 0.976 1.032 0.90
Geschlecht 114 -1.258 0.521 0.284 0.169 0.479 0.016*
Nikotin 114 0.438 1.128 1.550 0.502 4.786 0.70
Nierenerkrankung 114 -0.718 0.606 0.488 0.266 0.894 0.24
oral 112 0.954 1.013 2.597 0.943 7.151 0.35
jährlich 112 -2.088 1.579 0.124 0.026 0.601 0.19
Osteoporose 114 -0.076 0.781 0.927 0.424 2.024 0.92
Zytostatika 114 1.312 0.647 3.715 1.945 7.096 0.043*
Zoledronat 114 0.424 0.825 1.528 0.670 3.486 0.61
Risedronat 114 2.376 1.130 10.767 3.478 33.331 0.035*
3 signifikante Prediktoren, p= 0.00038***
Geschlecht 114 -1.080 0.428 0.340 0.221 0.521 0.012*
Zytostatika 114 1.415 0.633 4.118 2.186 7.755 0.025*
Risedronat 114 1.977 0.785 7.224 3.295 15.839 0.012*
HR = Hazard Rate. Geschlecht codiert 1 = m, 2 = w, oral codiert 15 = iv, 16=oral.

46
Mit diesem multivariaten Verfahren untersuchten wir zehn Prediktoren, welche zuvor in
univariaten Prüfungen zum Teil signifikant waren.
Die zehn primären Variablen wurden schrittweise reduziert anhand zu großer
Signifikanzwerte (p), bis schließlich nur noch drei signifikante Prediktoren verblieben.
Diese sind das Geschlecht, die Einnahme von Zytostatika zusätzlich zur
Bisphosphonattherapie und Risedronat als BIS-Präparat.
Männer haben ein 0,2-0,5fach höheres Risiko an einer BONJ zu erkranken als Frauen.
Bisphosphonatpatienten, welche zusätzlich Zytotatika einnehmen, haben ein im Schnitt
um das Vierfache höheres Risiko eine Bisphosphonat assoziierte Kieferknochennekrose
zu bekommen, als Patienten, welche nicht zusätzlich Zytostatika verabreicht
bekommen.
Wird Osteoporose oder eine maligne Grunderkrankung mit Risedronat therapiert, so
kann sich durchschnittlich mit einem siebenfach höheren Risiko eine Nekrose
entwickeln, im Vergleich zur Therapie mit anderen Präparaten.
4.8 Befund bei Baseline-Untersuchung
Von den 150 Patienten der Baseline-Untersuchung lag bei 28 (18.7%) eine Nekrose vor.
Bei 15 Patienten wurde die Nekrose bei der Baseline-Untersuchung entdeckt und bei 13
Patienten lag die Nekrose-Diagnose bereits vor der Baseline-Untersuchung. Im Folgen-
den werden zur Wahrung der Daten nur die Initialen der Patienten zur Anamnese er-
wähnt.
Ein zur Baseline-Untersuchung 73-Jähriger Patient (R.H.), welcher Bisphosphonate
wegen eines Prostatakarzinoms bekam, stellte sich mit einer BONJ im dritten
Quadranten im Stadium eins vor. Man führte es auf eine Druckstelle an der
Klammerprothese zurück. Eine Sequesterotomie in der nekrotischen Region und ein
plastischer Wundverschluss wurden vorgenommen. Es ist kein Rezidiv, da eine
zurückliegende BIS-Nekrose im zweiten Quadranten auftrat.
Eine seit mehr als 20 Jahren an Rheuma leidende und Zometa wegen starker
Osteoporose bekommende Patientin (L.B.) stellte sich nach einer austherapierten BONJ

47
mit einer Fistelung am linken Kieferwinkel in der BIS-Sprechstunde vor. Pus war zu
dem Zeitpunkt nachweisbar. Eine stationäre Aufnahme folgte. Ein halbes Jahr später
wurde sie erneut vorstellig – diesmal diagnostizierte man einen Abszess im linken
Kieferwinkel. Dieser wurde operativ gespalten und gespült. Zum Beobachtungsende
gab es keinen Anhalt auf ein Rezidiv.
Die im Jahre 1993 diagnostizierte Grunderkrankung multiples Myelom war der Grund
für die BIS-Therapie eines zur Baseline 56-Jährigen (M.S.). Im Jahre 1997 kam es zu
einer Radiatio im Kopf-Hals-Bereich. Bisphosphonate nahm er von 2000 bis 2007 ein.
Im Jahre 2007 litt er unter einer BONJ nach einer Zahnextraktion und WSR im
3.Quadranten. Die Therapie bestand in einer operativen Sequesterotomie, einem
Plastischen Wundverschluss und einer intravenösen Antibiose.
Eine zum Zeitpunkt der Baseline 78-Jährige Patientin (H.T.) stellte sich im Zustand
nach zweimaliger Bisphosphonat assoziierter Kieferknochennekrose vor ohne Verdacht
auf ein Rezidiv. Im Jahre 2007 (dritter Quadrant, Stadium drei) und 2008 (vierter
Quadrant, Stadium zwei) litt sie unter einer BONJ. Es war kein Rezidiv, sondern es
handelte sich um eine Zweitlokalisation. Eine Zahnextraktion und eine Kürettage waren
die Auslöser 2007. Ein Jahr später führte eine erneute Extraktion, diesmal im vierten
Quadranten zu einer BONJ. Die Therapie bestand in einer Sequesterotomie, einem
plastischen Wundverschluss, einer intravenösen Antibiose mit Sobelin und einer
desinfizierenden Spülung mit Hexoral dreimal täglich. Bis zum Beobachtungsende war
die Patientin rezidivfrei.
G.W. wurde wegen eines Lymphoms in der Lendenwirbelsäule mit Zometa behandelt.
Ursprünglich im monatlichen, im Anschluss im zweimonatigen und schließlich im
halbjährlichen Intervall. Im Jahr zuvor erkrankte sie an BONJ, sie litt unter Schmerzen,
Sensibilitätsstörungen und Pusaustritt. Zudem war das betroffene Areal geschwollen.
Nach einer operativen Nekroseabtragung und Antibiose stellte sie sich im Follow-up
nekrose- und rezidivfrei vor.
Eine im Jahre 1998 an einem Mammakarzinom erkrankte Patientin wurde vierteljährlich
mit Zometa prophylaktisch behandelt. Im Jahre 2009 entwickelte sie eine BONJ regio
14/15, nachdem ihr kurze Zeit zuvor der Zahn 15 gezogen und in diesem Gebiet eine
Implantation vorgenommen wurde. Die anschließende Therapie bestand aus
Dekortikation, Nekroseabtragung mit plastischem Wundverschluss, sowie Antibiose.

48
G.F. ist eine Mammakarzinom-Patientin mit ossären Metastasen. Zudem litt sie unter
einer chronischen Parodontitis. Die therapeutische Zometagabe erfolgte monatlich.
2009, nach nur einjähriger BIS-Gabe, erkrankte sie an einer BONJ regio 17.
U.G. ist ein Prostatakarzinom-Patient mit ossären Metastasen in den
Lendenwirbelkörpern. Er nahm täglich Alkohol zu sich. Therapiert wurde er von 2005-
2007 vierteljährlich mit Zoledronat, anschließend im selben Intervall mit Pamidronat.
Im Jahre 2007 diagnostizierte man regio 36 eine BONJ, nachdem wenige Monate zuvor
der Zahn 36 extrahiert wurde. Die Nekrose wurde operativ entfernt, die Wunde wurde
plastisch verschlossen. Die Antibiose erfolgte oral und intravenös. Beim Follow-up ein
halbes Jahr später stellte er sich beschwerdefrei vor.
Ein männlicher Osteoporosepatient (H.N.) wurde anfangs für ein Jahr im monatlichen
Abstand mit Zoledronat behandelt. 2004-2010 nahm er wöchentlich Risedronat oral ein.
Im Jahre 2005 wurde seine BONJ regio 37 durch eine Sequesterotomie und
Antibiotikagabe behandelt.
Ein zum Zeitpunkt der Untersuchung 70-Jähriger Osteoporose- und
Plasmozytompatient mit ossären Metastasen in der gesamten Wirbelsäule, wird seit
2004 monatlich mit Ibandronat therapiert. Er konsumiert täglich Alkohol. 2008, nach
Extraktion von vier Zähnen, wird ein freiliegender Knochen regio 36 mit Rötung
diagnostiziert. Der Patient gab an, Schmerzen zu haben. Eine kombinierte Therapie aus
Nekroseabtragung, lokaler Wundrevision und Antibiose folgte.
G.H. wurde wegen eines multiplen Myeloms und Osteoporose mit Pamidront im
monatlichen Abstand behandelt. In regio 22 wurde eine BONJ festgestellt und
anschließend durch Sequesterotomie, Antibiose und Prothesenkarenz therapiert. Im
Follow-up war er beschwerde- und symptomfrei.
Eine 63-Jährige Brustkrebspatientin, welche ossäre Metastasen in den
Brustwirbelkörpern aufwies wurde zwei Jahre lang mit Zoledronat im dreimonatigen
Abstand behandelt. Zwei Jahre nach Absetzen des Bisphosphonats, wurde die Patientin
wegen einer Schwellung regio 43 , Foetor ex ore und Pusaustritt vorstellig. Vier Monate
vor der Diagnose der BONJ fiel der Zahn 43 aufgrund galoppierender Parodontitis aus.
Die anschließende Sequesterotomie und Antibiose führten dazu, dass die Patientin im
Follow-up beschwerdefrei war.

49
Tabelle 21. Nekroseprävalenzrate bei Baseline-Untersuchung
n %
noch keine BIS-Medikation 36 24.00
keine Nekrose unter BIS-Medikation 86 57.33
Nekrose unter BIS bei Baseline diagnostiziert 15 10.00
Nekrose bei Baseline bereits bekannt. 13 8.67
n = 150
Zum Zeitpunkt der Erstuntersuchung im Rahmen dieser Studie eines jeden Patienten
kamen die vier oben tabellarisch aufgeführten Begebenheiten vor.
Während der gesamten Studienzeit wurden insgesamt 36 Patienten vorstellig, welche
wegen eines zahnmedizinischen Check-ups in die Klinik kamen, denn vor erstmaliger
Bisphosphonatgabe ist es ratsam oral saniert zu sein [58].
86 Studienteilnehmer standen unter Bisphosphonattherapie und erlitten keine BONJ.
Bei 10% wurde eine BONJ während der Erstuntersuchung diagnostiziert und weitere
9% wussten bereits von ihrer Erkrankung und wurden wegen finaler Diagnose,
Zweitmeinung und/oder Behandlung in unsere Sprechstunde überwiesen.
Abbildung 14. Nekrosehäufigkeit
Sektoren für (V1102)= 3, 2, 1, 0,
13Nekrose vor base
15
Nekrose neu
86keine Nekrose unter BIS
36
noch kein BIS
n = 150

50
4.8.1 Geschlecht, Alter und Nekrosebefund bei Baseline
Tabelle 22. Geschlecht und Nekrosestatus bei Baseline
Geschlecht
männlich weiblich
n % n % p
Nekrosestatus keine BIS-Therapie 18 50.00% 18 50.00%
keine Nekrose 21 24.42% 65 75.58%
neue Nekrose 10 66.67% 5 33.33%
bekannte Nekrose 6 46.15% 7 53.85% 0.0022**
Gesamt 55 36.67% 95 63.33%
Die Prozente beziehen sich auf die Zeile, d.h. auf den Status.
Die geschlechtsspezifische Aufteilung bezüglich der Daten, welche zur Baseline
erhoben wurden, zeigen auf, dass zusammen genommen 16 von 55 Männern eine neue
oder bereits behandelte Nekrose aufzeigten. Bei den Frauen waren es 12 von 95.
Bei beiden Geschlechtern waren je 18 Patienten zur Voruntersuchung im Klinikum. 86
Patienten waren bei der Erstuntersuchung nekrosefrei bei gleichzeitiger Bisphosphonat-
Therapie, davon waren 76% Frauen und 24% Männer.
Tabelle 23. Alter und Nekrosestatus bei Baseline
Alter
n MW ST pkw
Nekrosestatus keine BIS-Therapie 36 61.5884 13.9617
keine Nekrose unter BIS 86 59.7721 12.2383
neu diagnostizierte Nekrose 15 66.8351 7.9142
bekannter Nekrosebefund 13 67.2186 8.4840 0.034*
Gesamt 150 61.5597 12.2619
Im Durchschnitt waren die 150 vorstelligen Patienten circa 62 Jahre alt. Ebenso alt war
die Gruppe, welche zur Voruntersuchung vor erstmaliger BIS-Applikation kam. Die
größte Gruppe (n=86) war im Mittel am jüngsten mit 60 Jahren.
Die Patienten, welche neu an einer Nekrose erkrankten beziehungsweise eine Therapie
der BONJ bereits durchliefen, waren mit durchschnittlich 67 Jahre am ältesten.

51
4.8.2 Allgemeine Erkrankungen, Risiken und Nekrosebefund bei Baseline
Tabelle 24. Erkrankungen und Nekrosebefund
BONJ
kein BIS ohne Nekr Nekr neu Nekr war
n % n % n % n % p
Alkohol ja 5 31.25% 6 37.50% 2 12.50% 3 18.75%
nein 31 23.13% 80 59.70% 13 9.70% 10 7.46% 0.32
Allergien ja 16 30.19% 27 50.94% 5 9.43% 5 9.43%
nein 20 20.62% 59 60.82% 10 10.31% 8 8.25% 0.58
Allg. Erkr. ja 12 22.22% 27 50.00% 8 14.81% 7 12.96%
nein 24 25.00% 59 61.46% 7 7.29% 6 6.25% 0.21
DM ja 5 23.81% 11 52.38% 4 19.05% 1 4.76%
nein 31 24.03% 75 58.14% 11 8.53% 12 9.30% 0.52
Herzerkr. ja 16 23.19% 38 55.07% 6 8.70% 9 13.04%
nein 20 24.69% 48 59.26% 9 11.11% 4 4.94% 0.36
Hyperchol. ja 6 22.22% 14 51.85% 4 14.81% 3 11.11%
nein 30 24.39% 72 58.54% 11 8.94% 10 8.13% 0.77
Hyperurik. ja 1 33.33% 1 33.33% 1 33.33% 0 0.00%
nein 35 23.81% 85 57.82% 14 9.52% 13 8.84% 0.29mp
Lebererkr. ja 2 22.22% 6 66.67% 1 11.11% 0 0.00%
nein 34 24.11% 80 56.74% 14 9.93% 13 9.22% 1.00mp
Nierenerkr. ja 2 10.53% 11 57.89% 4 21.05% 2 10.53%
nein 34 25.95% 75 57.25% 11 8.40% 11 8.40% 0.24
Nikotin ja 6 54.55% 1 9.09% 3 27.27% 1 9.09%
nein 30 21.58% 85 61.15% 12 8.63% 12 8.63% 0.0017**mp
Rheuma ja 1 11.11% 5 55.56% 1 11.11% 2 22.22%
nein 35 24.82% 81 57.45% 14 9.93% 11 7.80% 0.30 mp
Gesamt 36 24.00% 86 57.33% 15 10.00% 13 8.67% –
Nekrosebefund ist der Befund bei Baseline. n = Anzahl der Patienten mit einer oder mehreren Erkran-
kungen, bezogen auf die untersuchten 150 Patienten
Diese Berechnung wurde mit dem Ziel erstellt, herauszufinden, ob Risiken oder
Erkrankungen, welche keine Grunderkrankungen sind, die Entstehung einer BONJ
begünstigen. Dabei wurde unterschieden, welche Diagnose bei der Baseline festgestellt
wurde. Entweder befanden sich die Patienten noch nicht unter BIS-Therapie (= kein
BIS) oder wenn sie bereits mit Bisphosphonaten behandelt wurden, gab es die
Möglichkeiten, dass die Patienten nekrosefrei waren (= ohne Nekr), dass die BONJ
während der Baseline diagnostiziert wurde (= Nekr neu) oder dass eine bereits
behandelte BONJ nachkontrolliert wurde (= Nekr war). Die Tabelle umfasst alle 150
Patienten, davon wurden 36 noch nicht mit BIS therapiert. Bei 86 Studienteilnehmern
lag bei Baseline keine BONJ vor, 15 Patienten wiesen erstmals eine Nekrose auf und 13

52
Probanden stellten sich nach einer bereits therapierten BONJ wieder vor. Jede
Erkrankung ergibt summiert in ihrer Doppelzeile 100%.
Der einzig signifikante Wert war das Nikotin. Insgesamt zehn Patienten gaben an
regelmäßig zu rauchen, sechs davon hatten während Baseline noch keine BIS-Therapie
begonnen, bei drei Patienten hingegen wurde während der Baseline eine BONJ
diagnostiziert. Täglichen Alkoholkonsum gaben 16 Studienteilnehmer an, zwei davon
erhielten bei Base die Diagnose BONJ, drei entwickelten bereits in der Vergangenheit
eine und kamen zur Nachuntersuchung.
Der als “andere Allgemeinerkrankung” zusammengefasste Unterpunkt impliziert
beispielsweise Hypertonie, Arthrosen, Bronchitiden, Hämophilien und Weiteres. Diese
anderen Allgemeinerkrankungen hatten mit acht neu diagnostizierten BONJ den
höchsten Wert, welcher auf das breite Spektrum und die hohe Fallzahl (insgesamt von
54 Patienten angegeben) zurück zu führen ist. Bei Herzerkrankungen lag die Zahl (n=6)
der neu diagnostizierten BONJ am zweithöchsten. Zudem hatten neun Patienten dieser
Gruppe bereits eine BONJ. Allerdings wurde auch von insgesamt 69 Patienten und
somit am häufigsten eine Herzerkrankung angegeben. Von 53 Patienten wurden
Allergien aufgeführt, jeweils fünf Patienten entwickelten eine BONJ beziehungsweise
durchlitten bereits eine.
Einer von drei unter Hyperurikämie leidenden Studienteilnehmern wiesen zum
Zeitpunkt der Baseline eine BONJ auf. Das ergibt einen Prozentsatz von 33,33 und
damit den höchsten aller Erkrankungen, die nicht zu den Grunderkrankungen zählen.
Nikotin (27%), Nierenerkrankungen (21%) und Diabetes mellitus (19%) erzielen die
nächst höheren Werte.
Mit 22,22% ist Rheuma prozentual der Höchstwert bei den Patienten mit therapierter
BONJ. Bei den neu Erkrankten war der Wert halb so groß.

53
4.9 Auslöser der Nekrose
Tabelle 25. Auslöser der Nekrose bei den Nekrosepatienten
Auslöser n % 95%-CI
Extraktion an der befallenen Stelle 18 64.29% 44.07% 81.36%
Druckstelle 9 32.14% 15.88% 52.35%
Implantatinsertion 3 10.71% 2.27% 28.23%
PA-Behandlung 3 10.71% 2.27% 28.23%
Wurzelspitzenresektion 2 7.14% 0.88% 23.50%
Zystektomie 1 3.57% 0.09% 18.35%
Schlechte MH 1 3.57% 0.09% 18.35%
n = Anzahl der auslösenden Faktoren der untersuchten 28 Patienten mit BIS-Nekrose
Abbildung 15. Nekrose-Auslöser
0
5
10
15
20
25
Anzahl %
05
10
15
20
25
30
35
40
45
5055
60
65
70
75
80
85
90
95
100
Histogramme von extrak(V176),(V99),drucks(V180),(V99),implan(V181),(V99),pa_beh(V182),(V99),wsr(V183),(V99),zystek(V184),(V99),habit(V185)
Abschnitte für Werte = 1, 0,
Nur (V1102)>1
Extrakt DruckS Impl PA WSR Zyst Habit
Die Säulen stellen Anzahl (n) und Prozentsatz der nachgewiesenen Auslöser der Nekrose der untersuch-
ten 28 Patienten dar. Extrakt = Zahnextraktion, DruckS = Druckstelle, Impl = Implantatinsertion, PA =
PA-Behandlung, Zyst = Zystektomie, Habit = Schlechte Mund-Hygienegewohnheit.

54
Eine Extraktion an der betroffenen Stelle lag zu 64% vor. Ein Drittel der Patienten hatte
Druckstellen an der nekrotisierenden Stelle, was somit der weitaus häufigste Auslöser
war. Selten (10%) führten Implantationen und Parodontitistherapien zu einer BIS-
Nekrose.
Bei einem Teil der Patienten waren zwei oder mehr Auslöser bekannt .
Bei 11 Patienten war genau ein Auslöser bekannt, am häufigsten die Extraktion. 7
Patienten hatten 2 Auslöser, immer in Verbindung mit Extraktionen.
4.9.1 Alter, Geschlecht und chirurgischer Eingriff
Eine Implantatinsertion als Auslöser wurde bei 3 von 12 (25%) der Patientinnen
nachgewiesen, aber bei keinem männlichen Patienten (p = 0.067fy). Auch eine PA-
Behandlung stellte nur bei 3 von 12 Patientinnen aber bei keinem der 16 männlichen
Patienten einen Auslöser der Nekrose dar (p = 0.067fy).
Abbildung 16. Geschlecht und Auslöser der Nekrose
0
2
4
6
8
10
12
14
16
18Anzahl %
0
5
10
15
20
25
30
35
40
45
50
55
60
Histogramme von extrak(V176),(V99),drucks(V180),(V99),implan(V181),(V99),pa_beh(V182),(V99),wsr(V183),(V99),zystek(V184),(V99),habit(V185)
Abschnitte für Geschl(V228)= 1, 2,
Nur (V1102)>1
Extraktion DruckS Implant PA WSR Zyst Habit
Die Säulen sind nach Geschlecht unterteilt, ■ = männlich, ■ = weiblich. Extraktion = Zahnextraktion,
DruckS = Druckstelle, Impl = Implantatinsertion, PA = PA-Behandlung, WSR = Wurzelspitzenresektion,
Zyst = Zystektomie, Habit = Schlechte Mund-Hygienegewohnheit.

55
Extraktionen und Druckstellen führten zumeist bei Männern zur BIS-Nekrose (n=10/18
und n=6/9). Die Zystektomie war bei einem Mann der Auslöser für die BONJ.
4.9.2 Grunderkrankung und chirurgischer Eingriff
Von 7 Patientinnen mit Mamma-Ca mit BONJ hatten 3 (43%) eine Implantat-Insertion
als Auslöser, von den 21 Patienten und Patientinnen mit anderen Grunderkrankungen
aber niemand (pfy = 0.011*). Wenn man diese Berechnung nur für weibliche Patienten
durchführt, dann verbleiben 5 Patientinnen ohne Mamma-Ca und ohne Implantat als
Auslöser, was aber wegen der geringeren Fallzahl nicht mehr signifikant ist (pfy = 0.20)
(Verweis auf Tab. 21).
4.9.3 BIS und Auslöser
Bei seltenen malignen Erkrankungen war die BIS-Therapie besonders häufig geplant
aber noch nicht begonnen.
Grunderkrankungen zeigten keine Unterschiede zwischen einem oder mehreren BIS-
Präparaten, soweit überhaupt schon eine Therapie begonnen worden war.
Alendronat und Risedronat wurden nur bei Osteoporose verordnet und Ibandronat meist
bei Osteoporose.
4.10 Symptome und Befund der Nekrose
Tabelle 26. Nekrosesymptome bei Baseline-Untersuchung
Symptom n % 95%-CI
Foetor ex ore 2 7.1429% 0.8770% 23.5035%
Osteomyelitis 3 10.7143% 2.2665% 28.2264%
Pus 8 28.5714% 13.2237% 48.6668%
Rötung 18 64.2857% 44.0650% 81.3593%
Schmerzen 13 46.4286% 27.5109% 66.1301%
Schwellung 5 17.8571% 6.0643% 36.8933%
Sensibilitätsstörung 3 10.7143% 2.2665% 28.2264%
Vincent-Syndrom 1 3.5714% 0.0904% 18.3478%
n = Anzahl der Nekrosesymptome der untersuchten 28 Patienten mit BIS-Nekrose

56
Eine BONJ äußerte sich am häufigsten mit einer Rötung (n=18), gefolgt von Schmerzen
im betroffenen Areal (n=13), Pus (n=8) und Schwellung (n=5). Sensibilitätsstörungen
(n=3) wurden vor allem in fortgeschritteneren Stadien vorgefunden. Foetor ex ore
wurde überraschenderweise nur von zwei Nekrosepatienten angegeben beziehungsweise
befundet. Die Subjektivität, Gewöhnung und Scham seitens des Patienten und der
Mundschutz des Behandlers können mögliche Erklärungen sein.
Das Vincent-Syndrom[59] ist eine Hyp- oder Anästhesie im Ausbreitungsgebiet des
Nervus mandibularis – diese Symptomatik wurde bei einem Patienten vorgefunden.
Die Mehrzahl der Patienten mit Nekrose wies mehrere Symptome auf. Aus diesem
Grund übersteigt die Gesamtzahl der Symptome die Anzahl der untersuchten 28
Patienten.
Tabelle 27. Nekrosestadium
n %
Nekrosestadium I 1 3.57
II 12 42.86
III 12 42.86
IV 3 10.71
n = 28

57
Abbildung 17. Nekrosestadium
Sektoren für stadiu(V175)= 1, 2, 3, 4,
Nur (V1102)>1
1 I
12
II
12
III
3
IV
n = 28 Patienten mit BIS-Nekrose
Von den 28 an einer BONJ erkrankten Patienten, wurde es nur bei 4% im ersten
Stadium entdeckt. Jeweils zwölf Patienten und somit je 43% stellten sich mit einer
BONJ im zweiten, beziehungsweise im dritten Stadium in der Sprechstunde der MKG
der Universität Erlangen vor. Fast 11% aller Probanden wurde gar erst im Endstadium
vorstellig.
Die Patienten mit bereits bekannter Nekrose wiesen keine anderen Stadien auf als die
bei der Baseline-Untersuchung neu diagnostizierten.
Zwischen den Symptomen und Alter oder Geschlecht der Patienten war kein
Zusammenhang zu erkennen.

58
4.11 Nekrosetherapie und follow up
Tabelle 28. Nekrosetherapie
n % 95%-CI
Sequesterotomie 20 71.43% 51.33% 86.78%
plastischer Wundverschluss 15 53.57% 33.87% 72.49%
Wundrevision 3 10.71% 2.27% 28.23%
Prothesenkarenz 5 17.86% 6.06% 36.89%
hyperbare Sauerstofftherapie 1 3.57% 0.09% 18.35%
Antibiose 16 57.14% 37.18% 75.54%
n = Anzahl der durchgeführten Therapien bezogen auf die 28 Patienten mit BIS-Nekrose
Bei einer diagnostizierten BONJ wurde zu 71% mit einer Sequesterotomie therapiert.
Eine antibiotische Abschirmung und ein plastischer Wundverschluss wurden in mehr
als der Hälfte der Fälle angewandt.
Die insgesamt 28 erkrankten Patienten wurden zumeist mit einer Kombination aus den
oben stehenden Therapiemöglichkeiten behandelt, weswegen die Gesamtzahl der
Therapien die Anzahl der Erkrankten übersteigt.
4.12 Follow up
Tabelle 29. Wahrgenommene Follow-Up-Termine
n %
Follow-up Termine keiner 49 56.98
1 29 33.72
2 5 5.81
3 3 3.49
n = 86 Patienten unter BIS-Therapie ohne Nekrose.
Als Follow-up wird die regelmäßige Wiedervorstellung der Patienten in der
Bisphosphonatsprechstunde bezeichnet. Halbjährliche Kontrollen wurden den Patienten
empfohlen. Bei Beschwerden im Mund-, Kiefer-, Gesichtsbereich ist es ratsam
entsprechend eher vorstellig zu werden.

59
Fast 57% (n=49) der Bisphosphonattherapierten nahmen keine Follow-up-Termine
wahr, 34% ließen sich noch einmal nachuntersuchen, 6% kamen zweimal zur Kontrolle
auch ohne Verdacht auf eine BONJ.
In der gesamten Untersuchungszeit nahmen die Patienten maximal drei
Nachuntersuchungstermine wahr (n=3).
Tabelle 30. Befund bei Follow up der Nekrosepatienten
Anzahl %
keine Follow-up-Untersuchungen 20 71.43
1. Zustand nach Behandlung einer BONJ 6 21.43
2. aktuell Hinweis auf das Vorliegen einer aufgetretenen BONJ
(inklusive Zweitlokalisation) 1 3.57
3. aktuell Hinweis auf das Vorliegen eines Rezidivs der BONJ
(nach Abheilung) 1 3.57
n = 28 Patienten mit Nekrose bei baseline-Untersuchung
In Tabelle 29 werden die Befunde im Follow-up der 28 BONJ-Patienten beschrieben.
Nur acht Patienten nahmen einen Nachsorgetermin wahr. Sechs Patienten (21%) ließen
das Operationsgebiet nach einer erfolgreich therapierten BONJ untersuchen, dabei gab
es keinen Anhalt auf eine erneute BONJ oder ein Rezidiv.
Bei einem Patienten wurde während des Follow-up eine erneute BONJ anderer
Lokalisation festgestellt. Ebenfalls ein Patient wies bei der Nachuntersuchung ein
Rezidiv auf trotz zuvor erfolgreich behandelter BONJ.

60
Tabelle 31. Befund bei Follow up
BIS/Nekrose bei Base
kein BIS keine N N bei Base N vor Base
(n = 36) (n = 86) (n = 15) (n = 13)
n % n % n % n %
BIS abgesetzt. vor base - - 29 33.7% 1 6.7% 2 15.4%
bei base - - 41 47.7% 9 60.0% 3 23.1%
fortges. - - 16 18.6% 5 33.3% 8 61.5%
Follow-up kein 35 97.2% 49 57.0% 12 80.0% 8 61.5%
1 1 2.8% 29 33.7% 3 20.0% 3 23.1%
2 0 0.0% 5 5.8% 0 0.0% 1 7.7%
3 0 0.0% 3 3.5% 0 0.0% 1 7.7%
Bef. aktuell BONJ 0 0.0% 0 0.0% 3 100.0% 3 60.0%
ohne N 1 100.0% 37 100.0% 0 0.0% 0 0.0%
akt.N 0 0.0% 0 0.0% 0 0.0% 1 20.0%
Rezid 0 0.0% 0 0.0% 0 0.0% 1 20.0%
k.A. 35 – 49 – 12 – 8 –
N = Nekrose, Base = Baseline-Untersuchung, BONJ = Z.n. Behandlung einer BONJ. Ohne N = Patient
unter BIS-Therapie ohne Nekrose, akt N = aktuell Hinweis auf das Vorliegen einer aufgetretenen BONJ
(inklusive Zweitlokalisation), Rezid = aktuell Hinweis auf das Vorliegen eines Rezidivs der BONJ (nach
Abheilung).
Tabelle 31 beschreibt in zusammengefasster Form den Verlauf aller 150
Studienteilnehmer. 36 Patienten nahmen bei der Baseline-Untersuchung noch keine
Bisphosphonate ein. Nur einer davon nahm ein Follow up nach ca. einem Jahr wahr –
eine Nekrose konnte dabei nicht festgestellt werden.
Zur Baseline waren 86 Patienten nekrosefrei, 34% hatten zu dieser Zeit die BIS-
Medikation bereits abgesetzt, 48% setzten sie nach der Baseline-Untersuchung ab und
19% führten die BIS-Medikation fort. 57% kamen zu keinem Nachsorgetermin, 29
Patienten ließen sich einmal nachuntersuchen, fünf Patienten zweimal und drei
Patienten sogar dreimal. Nekrotisch war im aktuellen Befund niemand, von dem eine
Angabe vorlag.
Insgesamt wurde bei 15 Studienteilnehmern zur Baseline eine BONJ diagnostiziert. Ein
Drittel (33%) führte die Therapie fort. Auffällig ist, dass nur 20% zur Nachkontrolle
kamen.
Im Falle von 13 Patienten lag die Diagnose BONJ bereits vor der Baseline vor, da in
dieser Studie auch retrospektive Daten verwendet wurden. Zwei Patienten (15%)
nahmen zum Zeitpunkt der Baseline keine Bisphosphonate mehr, diese wurden auch
nicht mehr in der Bisphosphonatsprechstunde vorstellig. Drei Patienten ließen sich ein
weiteres Mal nachuntersuchen, ein Patient kam zu zwei und ein weiterer Patient zu drei

61
Follow-up-Terminen. Der aktuelle Befund verzeichnetet von den insgesamt fünf erneut
vorstellig gewordenen Patienten drei BONJ, eine an einer anderen Region neu
aufgetretene BONJ und ein Rezidiv.

62
5 Diskussion
Die bisphosphonat-assoziierte Kieferknochennekrose ist aufgrund des breitflächigen
Einsatzes bei Erkrankungen wie zum Beispiel Osteoporose und Mammakarzinom, eine
etablierte Erkrankung[60]. Seit ihrer Erstbeschreibung im Jahre 2003 durch Marx [1]
wurde und wird sie vielfach mittels Studien zur Klärung der Ätiologie erforscht.
In der vorliegenden kombinierten retro- und prospektiven Studie wurden während der
gesamten Studienzeit 150 Patienten in der wöchentlich stattfindenden
Bisphosphonatsprechstunde der Universität Erlangen-Nürnberg klinisch intra- und
extraoral untersucht. Die BONJ ist eine klinische Diagnose. Radiologisch und
pathologisch erhobene Befunde sind unspezifisch [10,11]. Mehr als zwei Drittel (n=95)
der Studienteilnehmer waren Frauen, 55 Männer ergänzten das Patientenkollektiv. Bei
der hohen Anzahl von Frauen ist die Verteilung der in dieser Studie häufigsten
Grunderkrankung, weswegen eine BIS-Therapie eingeleitet wurde, evident. 67 Frauen
bekamen Bisphosphonate wegen eines Mammakarzinoms, 35 Patienten wegen
Osteoporose und 21 Männer wegen eines Prostatakarzinoms. Bisphosphonate wurden
prophylaktisch oder therapeutisch verabreicht . Zu einer prophylaktischen Applikation
kam es, wenn der Patient keine ossären Metastasen aufwies, aber an einem Karzinom
leidet, welches ossär metastasieren kann. Therapeutisch wurden BIS eingesetzt, wenn
der Knochen bereits geschwächt war, wie bei Osteoporose, beziehungsweise, wenn
ossäre Metastasen bereits nachgewiesen wurden. Die Applikation ist intravenös oder
oral möglich. Bevorzugt wurde intravenös (n=103) therapiert. Eine orale Bisphos-
phonattherapie erhielten neun Personen.
Nach fünfjähriger Beobachtungszeit wiesen die Patienten bei intravenöser Behandlung
eine Nekrosefreiheitsrate von 61,5% auf, bei oraler Therapie eine von 43%. Daraus lässt
sich schlussfolgern, dass Bisphosphonatpatienten mit oraler Therapieform ein höheres
Risiko haben, eine BONJ zu entwickeln. Dieses Ergebnis steht im Gegensatz zu den
bisher in der Literatur vorgefundenen Ergebnissen.
Als Risikofaktor zur Entwicklung einer BONJ wird eine Langzeittherapie mit
Bisphosphonaten angesehen. Innerhalb der ersten 24 Monate besteht sowohl bei
intravenös als auch oral Therapierten ein Risiko an einer BONJ zu erkranken [61]. Die

63
Therapiedauer ist allerdings nicht der alleinige ausschlaggebende Faktor, denn in der
Literatur wurde ebenso von Single-Shot-Nekrosen berichtet [62].
Auf Grund dieser Studie, welche von März 2009 bis Dezember 2011 prospektive
Patientendaten erfasste und zudem retrospektiv Datensätze von langjährig mit BIS
therapierten Patienten mit deren schriftlicher Einwilligung statistisch erhob, verfügt
diese Studie über eine Gesamtbeobachtungszeit von bis zu 11 Jahren. Dementsprechend
lassen sich Aussagen über Langzeitbehandlungen mit Bisphosphonaten ableiten.
Die Intervalle, in denen Bisphosphonate appliziert werden, sind mannigfaltig. Am
häufigsten (n=74) vertreten war das monatliche, gefolgt vom jährlichen Intervall
(n=24). Lediglich sieben Patienten wurden jede Woche mit BIS therapiert und weitere
sieben wurden zuerst monatlich und dann jährlich mit BIS versorgt.
Hoch signifikante Unterschiede ließen sich dabei zwischen den Geschlechtern
ausmachen. Männer wurden zu 95% monatlich mit Bisphosphonaten behandelt. Bei den
Frauen wurde auch die Mehrheit (55%) im monatlichen, gefolgt von vom jährlichen
(30%) Intervall therapiert.
Das Bisphosphonat der Wahl war bei 84 Patienten Zoledronat (74%), gefolgt von
Pamidronat (n=8, 7%). Risedronat und Alendronat wurden nur bei Osteoporose-
Patienten appliziert. Auffällig war zudem, dass sieben von den neun oral Therapierten
an Osteoporose litten. Ein weiterer Unterschied in der Therapie von Patienten mit
maligner Grunderkrankung ist, dass bei 86% die BIS-Applikation wöchentlich erfolgte.
Der Begriff “Nekrosefreiheitsrate” (NFR) ist definiert als das Fernbleiben einer BONJ
trotz Therapie mit Bisphosphonaten unabhängig von Applikationsform, Intervall oder
Präparat. Ziel dieser Studie war es, das Risiko eine BONJ zu entwickeln, abzuschätzen
und Aussagen darüber zu treffen, wie viele Patienten nekrosefrei bleiben.
Maßgeblich hilfreich dafür war die multivariate Statistik nach Cox. Sie enthielt zehn
Prediktoren. Sie sind definiert als mögliche Auslöser zur Entwicklung einer BONJ.
Diese waren das Alter, das Geschlecht, Nikotinabusus, das Vorliegen einer Nierener-
krankung, Osteoporose als Grunderkrankung, die orale Einnahme des Bisphosphonats,
das jährliche Intervall für die BIS-Applikation, die zusätzliche Einnahme von Zytostati-
ka und die Bisphosphonate Zoledronat oder Risedronat. Die Prediktoren wurden
schrittweise, abhängig von den kleinsten Signifikanzwerten, eliminiert. Die drei
Prediktoren mit den signifikantesten Werten bedingen singulär und noch mehr in
Kombination die Entwicklung einer BONJ. Männer haben ein 0,2-0,5fach höheres

64
Risiko eine BONJ zu entwickeln. Desweiteren führte eine zusätzliche Zytostatika-
Einnahme zu einem vierfach erhöhten Risiko an einer BIS-Nekrose zu erkranken. Der
dritte signifikante Prediktor ist das BIS-Präparat Risedronat. Patienten, welche damit
therapiert werden, tragen ein siebenfach höheres Risiko eine BONJ zu entwickeln.
Männer, welche mit Risedronat therapiert werden und zusätzlich Zytostatika
einnehmen, haben laut unserer Ergebnisse somit das höchste Risiko an einer BONJ zu
erkranken.
Ein signifikanter Zusammenhang zwischen gleichzeitiger BIS- und
Zytostatikaeinnahme wurde erstmals in einer Studie aus Hamburg aus dem Jahre 2013
von Assaf et al. Tbeschrieben. 169 intravenös mit Bisphosphonaten behandelten
Patienten wurden untersucht, 15 (=8,9%) entwickelten eine BONJ. Es wurde allerdings
kein statistisch relevanter Zusammenhang zum Geschlecht aufgezeigt [63] . Von allen in
unserer Studie untersuchten Patienten wurden sieben Personen zusätzlich zu den
Bisphosphonaten mit Zytostatika therapiert. Nach fünf Jahren war eine
Nekrosefreiheitsrate von 21% zu verzeichnen, bei den 107 Patienten, welche
ausschließlich mit Bisphosphonaten therapiert wurden, war die Nekrosefreiheitsrate
nach fünf Jahren 61%.
2014 wurde dem Geschlecht bei der Entwicklung einer BONJ in einer von Gabbert et
al. TI1 durchgeführten Studie eine maßgebliche Rolle zugeschrieben. 963 Patienten, die
Bisphosphonate erhielten und bei denen eine maligne Grunderkrankung vorlag, wurden
von 2004-2012 bezüglich der Einflussfaktoren zur Bildung einer BONJ untersucht.
Gabbert et al. beschreibt wie in der vorliegenden Studie, dass Männer nach kürzerer
BIS-Therapie eine BONJ entwickelten. Dem Alter wurde wie auch in der vorliegenden
Studie keine Signifikanz zugeschrieben. (siehe Tabelle 19) [64] . In der vorliegenden Ar-
beit wurden 95 Frauen und 55 Männer untersucht. Nach fünf Jahren unter BIS-Therapie
waren noch 68% der Frauen nekrosefrei, bei den männlichen Teilnehmern waren es
lediglich 42%.
In beiden eben aufgeführten Studien wurden nur Patienten mit intravenöser Applikation
des BIS berücksichtigt.
In der Literatur findet man üblicherweise eine Unterteilung von Bisphosphonatpatienten
in zwei Gruppen: die Bisphosphonatgruppe, welche maligne Karzinome aufweist und
aus diesem Grund hohe Dosen BIS intravenös verabreicht bekommt und die zweite
Gruppe sind die Osteoporosepatienten, welche kleinere Dosen BIS oral erhalten. Bei der

65
ersten Gruppe werden Inzidenzraten einer BONJ von 1-12% nach 36 Monaten der BIS-
Verabreichung und bei der zweiten Gruppe weniger als ein Fall pro 100.000 [65]
beschrieben. Die vorliegende Studie unterscheidet sich dahingehend (siehe Tab.17).
Nach fünf Jahren Beobachtungszeit, lag die Nekrosefreiheitsrate der oral Therapierten
mit 43% Nekrosefreiheitsrate wesentlich niedriger als die der intravenös Therapierten
(62%). Anzumerken sind die relativ unausgeglichen Patientenkollektive (n=103 i.v und
n=9 oral) und die wesentlich längere Beobachtungszeit.
Insgesamt wurden während der Studienzeit 28 Nekrosepatienten untersucht. Verglichen
mit den anderen Patienten dieser Studie war die Nekrose-Gruppe mit im Schnitt 67
Jahren die älteste. Die in der vorliegenden Arbeit häufigsten Auslöser für die Entwick-
lung einer BONJ bei insgesamt 28 Erkrankten waren Extraktionen (n=18), Druckstellen
(n=9), Implantatinsertionen und Parodontitistherapien (n jeweils 3). Zu 65% war eine
Zahnextraktion an einem mit BIS therapierten Patienten der Hauptauslöser für eine
BONJ. In der Literatur werden auch vergleichsweise hohe Werte (73% [66]) beschrieben.
Eine österreichische Studie legte bereits dar, dass eine Implantatinsertion während oder
nach einer stattgefundenen Bisphosphonattherapie eine Beschleunigung der Nekrose-
entwicklung bewirkt. Bereits vorhandene und vollständig abgeheilte Implantate und
eine daran anschließende BIS-Therapie weisen kein größeres pathologisches Potenzial
auf [67]. Eine retrospektive Studie von Famili P1 et al. aus dem Jahre 2011 kam zu dem
Ergebnis, dass eine dentale Implantation während oder nach einer oralen Bisphos-
phonattherapie den Implantaterfolg nicht klinisch relevant beeinflusse oder gar zu einer
BONJ führe. 211 Patientinnen wurden mit insgesamt 597 dentalen Implantaten von Ja-
nuar 2008 bis August 2010 versorgt. Kein einzelner Fall wies im Follow-up Symptome
einer BONJ auf. Bei einem Implantat kam es nicht zur Osseointegration und wurde in-
nerhalb eines Jahres ausgetauscht. Somit entsprach die Erfolgsrate dieser Studie von
98,7% den Standarderfolgsraten von Implantationen [68].
Von Bedeutung für die Therapie und des damit verbundenen Aufwandes ist das
Nekrosestadium, mit welchem sich die Patienten vorstellen. Nur knapp 4% stellten sich
im ersten Stadium bei uns vor. Die Mehrheit stellte sich im Stadium zwei und drei vor
(je n=fast 43%). Elf Prozent wurden im Endstadium vorstellig. Dementsprechend
invasiver und aufwendiger ist die Therapie. Diese kann grundsätzlich konservativ oder
chirurgisch erfolgen. Im Universitätsklinikum Erlangen wird bei einer diagnostizierten
BONJ primär chirurgisch therapiert, was sich auch an der in dieser Studie durchgeführ-

66
ten Therapie widerspiegelt: In 20 Fällen wurde eine Sequesterotomie vorgenommen, bei
16 Patienten wurde eine Antibiose eingeleitet und 15 mal erfolgte ein plastischer
Wundverschluss. In den meisten Fällen wurden mehrere Therapiemöglichkeiten
kombiniert. Ebenso die folgende prospektive Studie von Stockmann et al. P 2010 zeigt
die Überlegenheit der chirurgischen Therapie. Es wurden 50 BONJ-Patienten
untersucht. Bei allen Patienten wurde die betroffene Region mittels Osteotomie und
primärem Wundverschluss unter Allgemeinanästhesie durchgeführt. Im Anschluss
wurden sie alle zwei Monate für ein Jahr nachkontrolliert. Die Erfolgsrate lag nach
einem Jahr bei 89% [69]. Nach 20 Monaten lag die Erfolgsrate noch bei 84,2% (Stock-
man et al. 2014). Die Therapie bestand immer aus der Kombination aus Osteotomie,
primärem Wundverschluss und Antibiose. [70].
Um mögliche Rezidive oder erneute oder erstmalige BONJ möglichst frühzeitig zu
erkennen, wurden die Patienten einem halbjährlichen Follow-up zugeführt. Ziel war es
auch, die Patienten aufzuklären und zu sensibilisieren, sodass sie einerseits bei
scheinbar leichten Symptomen wiedervorstellig wurden und andererseits alle weiteren
Ärzte, insbesondere Zahnärzte über die momentan stattfindende oder in der
Vergangenheit stattgefundene BIS-Therapie zu informieren. Dies muss anhand der
vorliegenden Daten zukünftig weiter ausgebaut werden.

67
6 Anhang
6.1 Abbildungsverzeichnis
Abbildung 1. Geschlechtsverteilung............................................................................... 19 Abbildung 2. Alter und Geschlecht ................................................................................ 20 Abbildung 3. Risiken und Erkrankungen ....................................................................... 22 Abbildung 4. Grunderkrankung ...................................................................................... 23 Abbildung 5. Beobachtungszeit ...................................................................................... 27
Abbildung 6. Geschlecht und BIS-Intervall ................................................................... 30
Abbildung 7. Nekrosefreiheit ......................................................................................... 35
Abbildung 8. Alter und Nekrose..................................................................................... 36 Abbildung 9. Geschlecht und Nekrose ........................................................................... 38 Abbildung 10. Zytostatika und Nekrose ......................................................................... 39 Abbildung 11. BIS-Präparate und Nekrose .................................................................... 41
Abbildung 12. BIS-Darreichungsform und Nekrose ...................................................... 42 Abbildung 13. BIS-Intervalle und Nekrose .................................................................... 44
Abbildung 14. Nekrosehäufigkeit................................................................................... 49 Abbildung 15. Nekrose-Auslöser ................................................................................... 53 Abbildung 16. Geschlecht und Auslöser der Nekrose ................................................... 54
Abbildung 17. Nekrosestadium ...................................................................................... 57

68
6.2 Tabellenverzeichnis
Tabelle 1. Geschlecht und Alter ..................................................................................... 20 Tabelle 2. Risiken und Erkrankungen ............................................................................ 21 Tabelle 3. Grunderkrankung, die zur Bisphosphonat-Therapie führte ........................... 22
Tabelle 4. Medikamente ................................................................................................. 24 Tabelle 5. Zytostase und Chemotherapie ....................................................................... 25 Tabelle 6. BIS-Medikationen ......................................................................................... 25 Tabelle 7. BIS-Medikation ............................................................................................. 26 Tabelle 8. Alter und Bisphosphonat-Therapie ................................................................ 28
Tabelle 9. Geschlecht und BIS-Intervall ........................................................................ 29 Tabelle 10. Osteoporose und BIS-Therapie ................................................................... 31 Tabelle 11. Intervall und Grunderkrankung ................................................................... 32
Tabelle 12. Chemotherapie und Einnahmeform der BIS ............................................... 33 Tabelle 13. Nekrosefreiheitsrate ..................................................................................... 35 Tabelle 14. Alter und Nekrosefreiheitsrate seit Beginn der BIS-Therapie..................... 37 Tabelle 15. Geschlecht und Nekrosefreiheitsrate seit Beginn der BIS-Therapie ........... 38
Tabelle 16. Zytostatika und Nekrosefreiheitsrate seit Beginn der BIS-Therapie ........... 40
Tabelle 17. BIS-Präparat und Nekrosefreiheitsrate seit Beginn der BIS-Therapie ........ 41 Tabelle 18. BIS-Darreichungsform und Nekrosefreiheitsrate seit Beginn der BIS-
Therapie .......................................................................................................................... 43
Tabelle 19. BIS-Intervall und Nekrosefreiheitsrate seit Beginn der BIS-Therapie ........ 44 Tabelle 20. Multivariate Statistik nach Cox ................................................................... 45
Tabelle 21. Nekroseprävalenzrate bei Baseline-Untersuchung ...................................... 49 Tabelle 22. Geschlecht und Nekrosestatus bei Baseline ................................................ 50 Tabelle 23. Alter und Nekrosestatus bei Baseline .......................................................... 50
Tabelle 24. Erkrankungen und Nekrosebefund .............................................................. 51 Tabelle 25. Auslöser der Nekrose bei den Nekrosepatienten ......................................... 53
Tabelle 26. Nekrosesymptome bei Baseline-Untersuchung ........................................... 55 Tabelle 27. Nekrosestadium ........................................................................................... 56
Tabelle 28. Nekrosetherapie ........................................................................................... 58 Tabelle 29. Wahrgenommene Follow-Up-Termine ....................................................... 58 Tabelle 30. Befund bei Follow up der Nekrosepatienten ............................................... 59 Tabelle 31. Befund bei Follow up .................................................................................. 60

69
6.3 Abkürzungsverzeichnis
AAOMS American Association of Oral and Maxillofacial Surgeons
ATP Adenosintriphosphat
BIS Bisphosphonat(e)
BMP bone morphogenetic protein
BONJ Bisphosphonate Related Osteonecrosis of the Jaw
bzw. beziehungsweise
CI Konfidenzintervall, confidence interval
CTLA cytotoxic T-lymphocyte-associated Protein 4
CTX C-terminal Kollagen-Bruchstücke während Knochenresorption von Os-
teoklasten erzeugt
DM Diabetes mellitus
DMF-T D – decayed, M – missing, F – filled, T – teeth
DÖSAK Deutsch-Österreichisch-Schweizerischen Arbeitskreises für Tumoren im
Kiefer- und Gesichtsbereich
fy exakter Test nach Fisher und Yates
HR Hazard Ratio
i.v. intravenös
IgG Immunglobulin G
kw Rangvarianzanalyse nach Kruskal und Wallis
MAV Mund-Antrum-Verbindung
MKG Mund-Kiefer-Gesichtschirurgie
mp Exakter Test nach Mehta und Patel
MW Mittelwert
n Anzahl
n.s. nicht signifikant
NFR Nekrosefreiheitsrate
p(chi) p-Wert der Prediktoren in der mutlivariaten Überlebensstatistik
PA Parodontitis
p-Wert p -value von probability, bei konfirmatorischen Tests: Überschreitungs-
wahrscheinlichkeit, Signifikanzwert; englisch
RANKL Receptor Activator of NF-κB Ligand (Protein aus der Familie der Tu-
mornekrosefaktoren)
ST Standardabweichung
str(β) Streuung des Gewichtes der Prediktoren
Tab. Tabelle
VEGF Vascular Endothelial Growth Factor
WSR Wurzelspitzenresektion
Z.n. Zustand nach
β Gewicht der Prediktoren in der Multivariaten Überlebensstatistik

70
7 Danksagung
Mein Dank richtet sich an Herrn Prof. Dr. Dr. Dr. h. c. F. W. Neukam, Klinikdirektor
der Mund- Kiefer- und Gesichtschirurgischen Klinik des Universitätsklinikums
Erlangen für das Interesse und die Durchführung dieser Arbeit.
Herrn Prof. Dr. Dr. E. Nkenke danke ich für die Bereitstellung des Dissertationsthemas.
In besonderem Maße möchte ich Herrn Dr. Dr. Ph. Stockmann meinen Dank
aussprechen, der mit großem Engagement und Interesse dieses Dissertationsprojekt
betreut hat.
Herrn Dr. Dr. T. Schlittenbauer danke ich für die freundschaftliche Betreuung und die
sehr gute Zusammenarbeit.
Ich möchte mich bei allen Patienten bedanken, welche trotz ihres zum Teil erheblich
eingeschränkten gesundheitlichen Befindens an den Untersuchungen teilgenommen und
somit die vorliegende Arbeit ermöglicht haben.
Ganz besonders danke ich meinen Eltern. Ohne sie wäre diese Arbeit nicht möglich
gewesen.

71
8 Lebenslauf
Angaben zur Person
Name, Vorname Müller, Ricarda
Anschrift Alfred-Kästner-Straße 52, 04275 Leipzig
Geburtsdatum 29.07.1987
Geburtsort Leipzig
Familienstand ledig
Beruf Zahnärztin
Ausbildung und Studium
08.2000- 06.2006 Agricolagymnasium Hohenmölsen
Allgemeine Hochschulreife
10.2006 - 06.2013 Friedrich-Alexander-Universität Erlangen - Nürnberg
Studium der Zahnmedizin Naturwissenschaftliche Vorprüfung
Zahnärztliche Vorprüfung
Staatsexamen
Berufsausübung
Seit 11.2014 Vorbereitungsassistentin in Leipzig
Praxis Dipl. Stom. Birgit Treiber
07/08.2014 Auslandseinsatz mit Zahnärzte ohne Grenzen, Mongolei

72
9 Erklärung
Eidesstattliche Erklärung
Hiermit erkläre ich, Ricarda Müller, dass ich die vorgelegte Dissertation mit dem Titel
„Epidemiologische Datenerhebung von bisphosphonat-assoziierten Kiefernekrosen im
Patientengut der Mund-, Kiefer- und Gesichtschirurgischen Klinik am Universitätskli-
nikum Erlangen“ selbstständig angefertigt habe.
Es wurden nur die in der Arbeit ausdrücklich benannten Quellen und Hilfsmittel be-
nutzt.
Die Arbeit hat in gleicher oder ähnlicher Form noch keiner anderen Prüfungsbehörde
vorgelegen.
_______________ __________________
Datum Unterschrift

73
10 Literaturverzeichnis
1. Marx RE 2003 Pamidronate (Aredia) and zoledronate (Zometa) induced avascu-
lar necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 61(9):1115-
7.
2. AAOMS 2007 American Association of Oral and Maxillofacial Surgeons posi-
tion paper on bisphosphonate-related osteonecrosis of the jaws. J Oral Maxillo-
fac Surg 65(3):369-76.
3. Khosla S, Burr D, Cauley J, Dempster DW, Ebeling PR, Felsenberg D, Gagel
RF, Gilsanz V, Guise T, Koka S, McCauley LK, McGowan J, McKee MD,
Mohla S, Pendrys DG, Raisz LG, Ruggiero SL, Shafer DM, Shum L, Silverman
SL, Van Poznak CH, Watts N, Woo SB, Shane E 2007 Bisphosphonate-
associated osteonecrosis of the jaw: report of a task force of the American Socie-
ty for Bone and Mineral Research. J Bone Miner Res 22(10):1479-91.
4. Bortolini O, Fantin G, Fogagnolo M, Rossetti S, Maiuolo L, Di Pompo G, Avnet
S, Granchi D. 2012, Synthesis, characterization and biological activity of hy-
droxyl-bisphosphonic analogs of bile acids 52:221-9.
5. Reid IR 2009 Osteonecrosis of the jaw: who gets it, and why? Bone 44(1):4-10.
6. Bisphosphonattherapie von Knochenerkrankungen: Tumorosteolysen, Osteopo-
rose herausgegeben von A. A. Kurth,L. Hovy,T. Hennings, Ausgabe 4/2001 S.
37
7. Rogers MJ, Frith JC, Luckman SP, Coxon FP, Benford HL, Monkkonen J, Au-
riola S, Chilton KM, Russell RG 1999 Molecular mechanisms of action of
bisphosphonates. Bone 24(5 Suppl):73S-79S.
8. Rodan GA, Fleisch HA 1996 Bisphosphonates: mechanisms of action. J Clin
Invest 97(12):2692-6.
9. Bartl R, von Tresckow E, Bartl C: Bisphosphonat-Manual. ISBN 3-540-25362-
9. Springer Verlag 2006:54 ff.
10. Stockmann P, Hinkmann FM, Lell MM, Fenner M, Vairaktaris E, Neukam FW,
Nkenke E 2009 Panoramic radiograph, computed tomography or magnetic reso-
nance imaging. Which imaging technique should be preferred in bisphospho-
nate-associated osteonecrosis of the jaw? A prospective clinical study. Clin Oral
Investig.
11. Wimalawansa SJ 2008 Insight into bisphosphonate-associated osteomyelitis of
the jaw: pathophysiology, mechanisms and clinical management. Expert Opin
Drug Saf 7(4):491-512.
12. Otto S, Hafner S, Grotz KA 2009 The role of inferior alveolar nerve involve-
ment in bisphosphonate-related osteonecrosis of the jaw. J Oral Maxillofac Surg
67(3):589-92.
13. Ruggiero SL, Dodson TB, Assael LA, Landesberg R, Marx RE, Mehrotra B
2009 American Association of Oral and Maxillofacial Surgeons position paper

74
on bisphosphonate-related osteonecrosis of the jaws--2009 update. J Oral Maxil-
lofac Surg 67(5 Suppl):2-12.
14. Bamias A, Kastritis E, Bamia C, Moulopoulos LA, Melakopoulos I, Bozas G,
Koutsoukou V, Gika D, Anagnostopoulos A, Papadimitriou C, Terpos E,
Dimopoulos MA 2005 Osteonecrosis of the jaw in cancer after treatment with
bisphosphonates: incidence and risk factors. J Clin Oncol 23(34):8580-7.
15. Cartsos VM, Zhu S, Zavras AI 2008 Bisphosphonate use and the risk of adverse
jaw outcomes: a medical claims study of 714,217 people. J Am Dent Assoc
139(1):23-30.
16. Durie BG, Katz M, Crowley J 2005 Osteonecrosis of the jaw and bisphospho-
nates. N Engl J Med 353(1):99-102; discussion 99-102.
17. Mavrokokki T, Cheng A, Stein B, Goss A 2007 Nature and frequency of
bisphosphonate-associated osteonecrosis of the jaws in Australia. J Oral Maxil-
lofac Surg 65(3):415-23.
18. Walter C, Al-Nawas B, Grotz KA, Thomas C, Thuroff JW, Zinser V, Gamm H,
Beck J, Wagner W 2008 Prevalence and Risk Factors of Bisphosphonate-
Associated Osteonecrosis of the Jaw in Prostate Cancer Patients with Advanced
Disease Treated with Zoledronate. Eur Urol.
19. Boonyapakorn T, Schirmer I, Reichart PA, Sturm I, Massenkeil G 2008
Bisphosphonate-induced osteonecrosis of the jaws: Prospective study of 80 pa-
tients with multiple myeloma and other malignancies. Oral Oncol 44(9):857-69.
20. Tarassoff P, Csermak K 2003 Avascular necrosis of the jaws: risk factors in
metastatic cancer patients. J Oral Maxillofac Surg 61(10):1238-9.
21. 2005 Expert panel recommendations for the prevention, diagnosis, and treatment
of osteonecrosis of the jaws. Lda J 64(3):21-4.
22. Durie BG 2007 Use of bisphosphonates in multiple myeloma: IMWG response
to Mayo Clinic consensus statement. Mayo Clin Proc 82(4):516-7; author reply
517-8.
23. Stockmann P, Vairaktaris E, Wehrhan F, Seiss M, Schwarz S, Spriewald B,
Neukam FW, Nkenke E 2009 Osteotomy and primary wound closure in
bisphosphonate-associated osteonecrosis of the jaw: a prospective clinical study
with 12 months follow-up. Support Care Cancer.
24. Pautke C, Bauer F, Tischer T, Kreutzer K, Weitz J, Kesting M, Holzle F, Kolk
A, Sturzenbaum SR, Wolff KD 2009 Fluorescence-guided bone resection in
bisphosphonate-associated osteonecrosis of the jaws. J Oral Maxillofac Surg
67(3):471-6.
25. Abu-Id MH, Warnke PH, Gottschalk J, Springer I, Wiltfang J, Acil Y, Russo
PA, Kreusch T 2008 "Bis-phossy jaws" - High and low risk factors for bisphos-
phonate-induced osteonecrosis of the jaw. J Craniomaxillofac Surg 36(2):95-
103.
26. Biasotto M, Chiandussi S, Dore F, Rinaldi A, Rizzardi C, Cavalli F, Di Lenarda
R 2006 Clinical aspects and management of bisphosphonates-associated oste-
onecrosis of the jaws. Acta Odontol Scand 64(6):348-54.

75
27. Montebugnoli L, Felicetti L, Gissi DB, Pizzigallo A, Pelliccioni GA, Marchetti
C 2007 Biphosphonate-associated osteonecrosis can be controlled by nonsurgi-
cal management. Oral Surg Oral Med Oral Pathol Oral Radiol Endod
104(4):473-7.
28. Vescovi P, Merigo E, Meleti M, Fornaini C, Nammour S, Manfredi M 2007
Nd:YAG laser biostimulation of bisphosphonate-associated necrosis of the jaw-
bone with and without surgical treatment. Br J Oral Maxillofac Surg 45(8):628-
32.
29. Wutzl A, Biedermann E, Wanschitz F, Seemann R, Klug C, Baumann A,
Watzinger F, Schicho K, Ewers R, Millesi G 2008 Treatment results of bisphos-
phonate-related osteonecrosis of the jaws. Head Neck 30(9):1224-30.
30. Marx RE, Sawatari Y, Fortin M, Broumand V 2005 Bisphosphonate-induced
exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition,
prevention, and treatment. J Oral Maxillofac Surg 63(11):1567-75.
31. Reid IR, Bolland MJ, Grey AB 2007 Is bisphosphonate-associated osteonecrosis
of the jaw caused by soft tissue toxicity? Bone 41(3):318-20.
32. Migliorati CA 2003 Bisphosphanates and oral cavity avascular bone necrosis. J
Clin Oncol 21(22):4253-4.
33. Wood J, Bonjean K, Ruetz S, Bellahcene A, Devy L, Foidart JM, Castronovo V,
Green JR 2002 Novel antiangiogenic effects of the bisphosphonate compound
zoledronic acid. J Pharmacol Exp Ther 302(3):1055-61.
34. Fournier P, Boissier S, Filleur S, Guglielmi J, Cabon F, Colombel M, Clezardin
P 2002 Bisphosphonates inhibit angiogenesis in vitro and testosterone-
stimulated vascular regrowth in the ventral prostate in castrated rats. Cancer Res
62(22):6538-44.
35. Taylor KH, Middlefell LS, Mizen KD 2009 Osteonecrosis of the jaws induced
by anti-RANK ligand therapy. Br J Oral Maxillofac Surg.
36. Serra E, Paolantonio M, Spoto G, Mastrangelo F, Tet XeS, Dolci M 2009
Bevacizumab-related osteneocrosis of the jaw. Int J Immunopathol Pharmacol
22(4):1121-1123.
37. Ficarra G, Beninati F, Rubino I, Vannucchi A, Longo G, Tonelli P, Pini Prato G
2005 Osteonecrosis of the jaws in periodontal patients with a history of bisphos-
phonates treatment. J Clin Periodontol 32(11):1123-8.
38. Badros A, Weikel D, Salama A, Goloubeva O, Schneider A, Rapoport A, Fenton
R, Gahres N, Sausville E, Ord R, Meiller T 2006 Osteonecrosis of the jaw in
multiple myeloma patients: clinical features and risk factors. J Clin Oncol
24(6):945-52.
39. Dannemann C, Gratz KW, Riener MO, Zwahlen RA 2007 Jaw osteonecrosis
related to bisphosphonate therapy: a severe secondary disorder. Bone 40(4):828-
34.
40. Ibrahim T, Barbanti F, Giorgio-Marrano G, Mercatali L, Ronconi S, Vicini C,
Amadori D 2008 Osteonecrosis of the jaw in patients with bone metastases treat-
ed with bisphosphonates: a retrospective study. Oncologist 13(3):330-6.

76
41. Van den Wyngaert T, Huizing MT, Vermorken JB 2007 Osteonecrosis of the
jaw related to the use of bisphosphonates. Curr Opin Oncol 19(4):315-22.
42. Assael LA 2009 Oral bisphosphonates as a cause of bisphosphonate-related os-
teonecrosis of the jaws: clinical findings, assessment of risks, and preventive
strategies. J Oral Maxillofac Surg 67(5 Suppl):35-43.
43. Evio S, Tarkkila L, Sorsa T, Furuholm J, Valimaki MJ, Ylikorkala O, Tiitinen
A, Meurman JH 2006 Effects of alendronate and hormone replacement therapy,
alone and in combination, on saliva, periodontal conditions and gingival crevicu-
lar fluid matrix metalloproteinase-8 levels in women with osteoporosis. Oral Dis
12(2):187-93.
44. Abu-Id MH, Acil Y, Gottschalk J, Kreusch T 2006 [Bisphosphonate-associated
osteonecrosis of the jaw]. Mund Kiefer Gesichtschir 10(2):73-81.
45. Stockmann P, Vairaktaris E, Wehrhan F, Seiss M, Schwarz S, Spriewald B,
Neukam FW, Nkenke E 2010 Osteotomy and primary wound closure in
bisphosphonate-associated osteonecrosis of the jaw: a prospective clinical study
with 12 months follow-up. Support Care Cancer 18(4):449-60.
46. Marx RE, Cillo JE, Jr., Ulloa JJ 2007 Oral bisphosphonate-induced osteonecro-
sis: risk factors, prediction of risk using serum CTX testing, prevention, and
treatment. J Oral Maxillofac Surg 65(12):2397-410.
47. Khosla S, Burr D, Cauley J, Dempster DW, Ebeling PR, Felsenberg D, Gagel
RF, Gilsanz V, Guise T, Koka S, McCauley LK, McGowan J, McKee MD,
Mohla S, Pendrys DG, Raisz LG, Ruggiero SL, Shafer DM, Shum L, Silverman
SL, Van Poznak CH, Watts N, Woo SB, Shane E 2008 Oral bisphosphonate-
induced osteonecrosis: risk factors, prediction of risk using serum CTX testing,
prevention, and treatment. J Oral Maxillofac Surg 66(6):1320-1
48. Sarasquete ME, Garcia-Sanz R, Marin L, Alcoceba M, Chillon MC, Bal-
anzategui A, Santamaria C, Rosinol L, de la Rubia J, Hernandez MT, Garcia-
Navarro I, Lahuerta JJ, Gonzalez M, San Miguel JF 2008 Bisphosphonate-
related osteonecrosis of the jaw is associated with polymorphisms of the cyto-
chrome P450 CYP2C8 in multiple myeloma: a genome-wide single nucleotide
polymorphism analysis. Blood 112(7):2709-12.
49. Spriewald BM, Lefter C, Huber I, Lauer B, Wenkel H 2007 A suggestive associ-
ation of fuchs heterochromic cyclitis with cytotoxic T cell antigen 4 gene poly-
morphism. Ophthalmic Res 39(2):116-20.
50. Bisphosphonate-induced osteonecrosis of the jaws: a challenge, a responsibility,
and an opportunity. Int J Periodontics Restorative Dent 28(1):5-6 Marx RE
2008.
51. Landis BN, Dojcinovic I, Richter M, Hugentobler M 2007 Osteonecrosis of the
jaws: maxillofacial recommendations for bisphosphonate prescribers. J Intern
Med 261(1):101-2.
52. Ruggiero SL, Drew SJ 2007 Osteonecrosis of the jaws and bisphosphonate ther-
apy. J Dent Res 86(11):1013-21.

77
53. Wang EP, Kaban LB, Strewler GJ, Raje N, Troulis MJ 2007 Incidence of oste-
onecrosis of the jaw in patients with multiple myeloma and breast or prostate
cancer on intravenous bisphosphonate therapy. J Oral Maxillofac Surg
65(7):1328-31.
54. Wilkinson GS, Kuo YF, Freeman JL, Goodwin JS 2007 Intravenous bisphos-
phonate therapy and inflammatory conditions or surgery of the jaw: a popula-
tion-based analysis. J Natl Cancer Inst 99(13):1016-24.
55. ADA ADA 2006 Dental management of patients receiving oral bisphosphonate
therapy: expert panel recommendations. J Am Dent Assoc 137(8):1144-50.
56. Haubitz I Beschreibung statistischer Methoden (1995). Unveröffentlichte Auf-
stellung
57. Yelena Y. Janjigian,1 Kevin McDonnell,1 Mark G. Kris,1 Ronglai Shen,2 Came-
lia S. Sima,2 Peter B. Bach,2 Naiyer A. Rizvi,1 and Gregory J. Riely Pack Years
of Cigarette Smoking as a Prognostic Factor in Patients with Stage IIIB/IV Non-
Small Cell Lung Cancer
58. Diel IJ1, Bergner R, Grötz KA 2007Adverse effects of bisphosphonates: current
issues
59. Reichart, Hausamen, Becker, Neukam, Schliephake, Schmelzeisen 2002 Curri-
culum Zahnärztliche Chirurgie Band I S. 514
60. Lerman MA1, Xie W, Treister NS, Richardson PG, Weller EA, Woo SB
Conservative management of bisphosphonate-related osteonecrosis of the jaws:
staging and treatment outcomes
Osteotomy and primary wound closure in bisphosphonate-associated osteone-
crosis of the jaw: a prospective clinical study with 12 months follow-up.
62. Bamias A, Terpos E, Dimopoulos MA Avascular osteonecrosis of the jaw as a
side effect of bisphosphonate treatment.
Comment on Osteonecrosis of the jaw after a single bisphosphonate infusion in a
patient with metastatic renal cancer treated with sunitinib. [Onkologie. 2010]
63. Assaf AT1, Smeets R, Riecke B, Weise E, Gröbe A, Blessmann M, Steiner T,
Wikner J, Friedrich RE, Heiland M, Hoelzle F, Gerhards F 2013 Incidence of
bisphosphonate-related osteonecrosis of the jaw in consideration of primary dis-
eases and concomitant therapies.
64. Gabbert TI1, Hoffmeister B, Felsenberg D 2014 Oct 16 Risk factors influencing
the duration of treatment with bisphosphonates until occurrence of an osteone-
crosis of the jaw in 963 cancer patients.
65. Khan AA1, Sándor GK, Dore E, Morrison AD, Alsahli M, Amin F, Peters E,
Hanley DA, Chaudry SR, Lentle B, Dempster DW, Glorieux FH, Neville AJ,
Talwar RM, Clokie CM, Mardini MA, Paul T, Khosla S, Josse RG, Sutherland
S, Lam DK, Carmichael RP, Blanas N, Kendler D, Petak S, Ste-Marie LG,
Brown J, Evans AW, Rios L, Compston JE; Canadian Taskforce on Osteonecro-
sis of the Jaw 2009 Mar;36 Bisphosphonate associated osteonecrosis of the jaw
66. Mavrokokki T1, Cheng A, Stein B, Goss A 2007 Mar;65(3):415-23.Nature and
frequency of bisphosphonate-associated osteonecrosis of the jaws in Australia.

78
67. Holzinger D, Seemann R, Matoni N, Ewers R, Millesi W, Wutzl A., Effect of
dental implants on bisphosphonate-related osteonecrosis of the jaws., J Oral
Maxillofac Surg. 2014 Oct;72(10):1937.e1-8. doi: 10.1016/j.joms.2014.04.037.
68. Famili P1, Quigley S, Mosher TSurvival of dental implants among post-
menopausal female dental school patients taking oral bisphosphonates: a retro-
spective study.
69. Stockmann P1, Vairaktaris E, Wehrhan F, Seiss M, Schwarz S, Spriewald B,
Neukam FW, Nkenke E.; Osteotomy and primary wound closure in bisphospho-
nate-associated osteonecrosis of the jaw: a prospective clinical study with 12
months follow-up
70. Stockmann P1, Burger M, von Wilmowsky C, Ebker T, Lutz R, Bauersachs A,
Nkenke E, Neukam FW, Wehrhan F., The outcome after surgical therapy of
bisphosphonate-associated osteonecrosis of the jaw--results of a clinical case se-
ries with an average follow-up of 20 months. Clin Oral Investig. 2014
May;18(4):1299-304. doi: 10.1007/s00784-013-1092-2. Epub 2013 Aug 29.